- 顺反异构

顺反异构
发现历史
 顺反异构(3)贝采里乌斯建议把相同组成而不同性质的物质称为“同分异构(isomerism)‘’的物质。同分异构现象的发现以及从理论上的阐明,是在物质组成和绪构理论发展中迈出的重要一步,它开始了分子结构问题的研究,促进了有机化学的发展。
顺反异构(3)贝采里乌斯建议把相同组成而不同性质的物质称为“同分异构(isomerism)‘’的物质。同分异构现象的发现以及从理论上的阐明,是在物质组成和绪构理论发展中迈出的重要一步,它开始了分子结构问题的研究,促进了有机化学的发展。
在发现了酒石酸的旋光异构之后,1874年9月荷兰物理化学家范特霍夫(Jacobus Hendricus Van't Hoff.1852-1911)论帕斯特成果的小册子《化学的结构式......空间分布论》(Voorstel tot Uibreiding der...Structuur Formules in de Ruimte)在乌特勒支出版;1874年11月法国化学家勒·贝尔(Joseph Achille Lebel.1847-1930)的论文发表在巴黎的《化学会会刊》(Bulletin de La Societe Chimique)上,两人分别独立能用几何异构来解释延胡索酸Fumaric acid(反-丁烯二酸)和马来酸Maleic acid(顺-丁烯二酸)的异构现象。假定,围绕分子中两个碳原子的两个四面体,沿着四面体的一边联合在一起,表示不能转动的双键,然后,把氢基和羧基安置到两个模型中区,使他们不能重合。它们并不是旋光异构体,它们的物理性质有所差别,由此发现了顺反异构。
1964年,德国化学家肖莱马通过对脂肪烃的研究,认真考察了有机结构与性质的关系,证实了碳原子4个化学价的统一性,对同分异构现象作出合理的解释,使有机结构理论定型化。
定义内容
概念辨析
同分异构是指分子式相同但结构式不同的异构现象,它包括构造异构和立体异构。立体异构指的是原子或原子团互相连接的次序相同,但在空间的排列方式不同的异构现象。而顺反异构是指空间构象不同,顺反异构属于立体异构,故也属于同分异构。
产生条件
1.分子中至少有一个键不能自由旋转(否则将变成另外一种分子);
2.每个不能自由旋转的同一碳原子上不能有相同的基团,必须连有两个不同原子或原子团。
而下图,这两个模型都是不存在顺反异构现象的一般构型,这是因为左侧存在相同的原子或原子团,旋转之后还是同一个构型:![]()
示例: 下图中,除中间的双键存在顺反异构外,其余两侧的碳原子没有顺反异构,这是因为旁边连接有两个相同的氢原子基团。
命名方法
顺反异构命名法
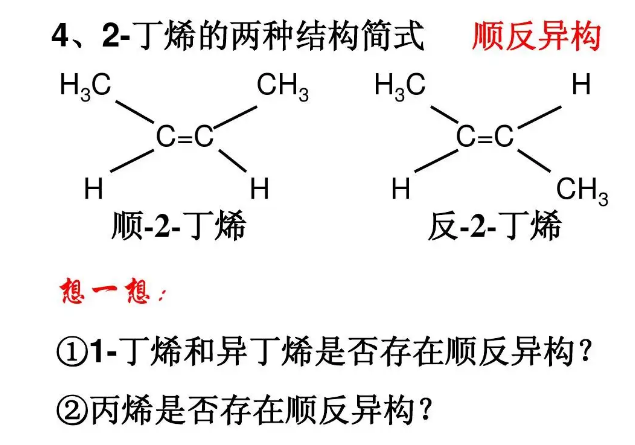
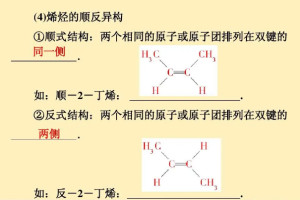
两个相同原子或基团在双键或脂环的同侧的为顺式异构体,也用 cis- 来表示。
两个相同原子或基团在双键或脂环的异侧的为反式异构体,也用 trans- 来表示。
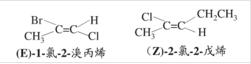
用顺反异构命名法命名的有机化合物例举
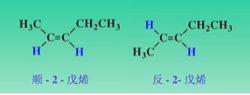
顺反命名法命名存在一个缺陷:若双键上两个碳原子上连有四个完全不同的原子或基团,就无法命名,因此国际规定了标准的Z-E命名法。但Z-E异构命名法不适用于因脂环引起的顺反异构的命名,这是因为脂环中的任一个碳原子已经连有两个相同的原子(碳原子),不存在连接四个完全不同基团的可能性。
两个碳原子上没有全连有四个相同的原子或基团的顺反异构体,既可以用Z-E命名法,也可以用顺反异构命名法。但需要注意的是,顺反异构体的命名与Z-E构型的命名不是完全相同的。这是两种不同的命名法,故顺式不一定就是Z型,反式不一定就是E型。
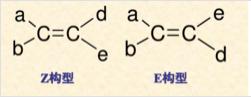
Z-E命名法
国际统一规定:按“顺序规则”分别比较每个碳原子上连接的两个原子或基团,若两个较优基团在π键平面同侧者为Z型异构体,在异侧者为E型异构体。Z和E分别取自德语“Zusammen”和“Entgegen”的首位字母,前者意思是“在一起”,后者的意思是“相反,相对”。
现假设下图构型式中的基团的次序是![]() ,则它们的构型分别为:
,则它们的构型分别为:
对于多烯烃的ZE异构,每个双键的构型均须要标出。对双键的第一个原子进行标号,并写在构型符号前面。若从两边编号双键都相同,而构型不同时,Z型在前。如下图所示,此化合物命名为(2Z,4E)-2-4-己二烯,而命名为(2E,4Z)-2-4-己二烯则是错误的。 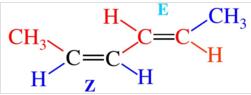
用Z-E命名法命名的有机化合物举例
次序规则
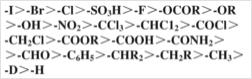
1.由碳上直接相连的两个原子的原子序数的大小来决定,原子序数大者为优。如I>Br>Cl>O>C>H。
若两个原子为同位素时,则比较相对原子质量数大小,质量高的为较优基团。如T>D>H。
2.若与碳原子直接相连的第一个原子相同,要依次比较第二个甚至第三个原子,依此类推,直到比较出优先顺序为止。
如甲基和乙基,甲基的第一个碳原子上连接了3个H原子,乙基的第一个碳原子连接了2个H原子和一个C原子,C的原子序数比H大,所以乙基为“较优”基团 。 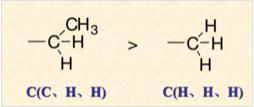
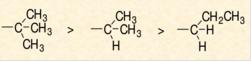
同理,如下图,三级碳原子>二级碳原子>一级碳原子。
3.当与碳原子相连的是不饱和基团时,如羰基,羧基,羟基,醛基等看作是和O连了两次,碳氮三键看作是和N连了三次。如下图,故羧基>醛基>羟基 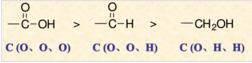
4.若与双键碳原子相连的基团互为顺反异构时,Z型先于E型。
5.若参与比较顺序的原子的键不到4个,例如氮原子,则可以补充适量的原子序数为零的假想原子,假想原子的排序放在最后。例如CH3CH=NCH3,这个N原子上除双键外有一个甲基,则假设它的第二个基团为一个原子序数为0的假想原子CH3->假想原子。
常见基团次序表
异构现象
 顺反异构(3)配合物的多种异构现象,大部分是由于立体结构不同或内界组成和配位体的连接方式不同而引起的。配位体在中心原子周围因排列方式不同而产生的异构现象,叫立体异构现象。顺式指同种配位体处于相邻位置,一般用“顺”或“cis-”表示;反式指同种配体处于对角位置,一般用“反”或“trans-”表示。
顺反异构(3)配合物的多种异构现象,大部分是由于立体结构不同或内界组成和配位体的连接方式不同而引起的。配位体在中心原子周围因排列方式不同而产生的异构现象,叫立体异构现象。顺式指同种配位体处于相邻位置,一般用“顺”或“cis-”表示;反式指同种配体处于对角位置,一般用“反”或“trans-”表示。
对于配位数为2、3、4(四面体)的配位化合物来说不存在这种异构现象,因为这些空间结构中的配位位置是彼此相邻的,没有反位的现象存在。但对于平面正方形和正八面体配位化合物来说,顺反异构现象则非常常见。
平面正方形配合物
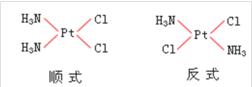
平面正方形的[MA2B2]类型配合物可有顺式和反式两种异构,如二氯·二氨合铂[PtCl2(NH3)2]有下列两种异构体:相同的配体Cl-和NH3处于顺位位置,为顺式异构体。相同的配体Cl和NH3处于反式位置,为反式异构体。
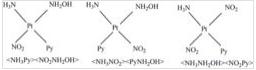
有少数Pt的平面正方形配位化合物含有4种不同的配体,这种情况下就会有三种异构体存在,如[Pt(NH3)NH2OH(Py)(NO2)]+配离子。这种情况就不能用简单的顺-反来表明,如下图,命名时一般是把两组反位的配体放在角括号里。
正八面体配合物
配位数为6的八面体结构,其顺反异构现象与平面正方形的情况类似,但情况较为复杂。
有两种配体的[MAB5]型配位化合物,没有几何异构体存在。
有两种配体的[MA2B4]型配位化合物,同样存在顺反异构现象,有两种立体异构体,如下图所示的[CoCl2(NH3)4]+: 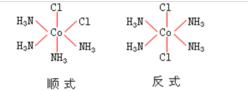
有两种配体的[MA3B3]型配位化合物,如[RhCl3(Py)3]也有两种异构体,将两种配体各自连成相互平行的平面称为面式异构体(顺-顺式异构体),用“cis,cis-”表示,反之若两平面相互垂直则称为经式异构体(顺-反式异构体),用“cis,trans-”表示。 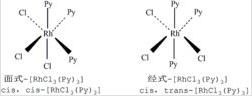
有三种配体的[MAB2C3]型配位化合物有3种异构体。 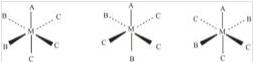
有三种配体的[MA2B2C2]型配位化合物有5种异构体。 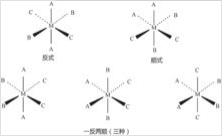
对于[MABCDEF]这样的配位化合物应该有15种几何异构体,唯一存在的此类配位化合物为[Pt(Py)(NH3)(NO2)(Cl)(Br)(I)],但只制得其中的三种。
性质差异
物理性质
顺反异构体的物理性质有所不同,并表现出一些规律性,其中较显著的有:燃烧热、熔点、溶解度和偶极距。
熔点:反式异构体中的原子排列比较对称,分子能规则地排入晶体结构中,其分子所构成的晶体的分子间的色散力就越大,晶格能则越大,因而具有较高的熔点。

偶极距和溶解度:一般来说,顺式异构体的偶极矩都大于反式异构体。因为反式异构体上的两个取代基极性方向相反,尽管取代基不同影响力不同,如CH3和CH3CH2基团,仍可以可以完全或部分抵消。而顺式异构体中两个电负性相同的原子或原子团处在分子的同侧,不像反式那样比较对称地排列,则不能产生这种抵消,从而在矢量合力方向上产生一个偶极矩。因而顺式分子的偶极距比反式大,为偶极分子,有微弱的极性,因此在水中的溶解度也就比较大。
燃烧热(heat of combustion):它是指一摩尔化合物完全燃烧生成二氧化碳和水所放出的热量,其大小可反映分子能量的高低,所以常可作为有机物相对稳定性的根据。通常有机物越稳定,分子能量就越低,就具有较小的燃烧。反式异构体的燃烧比顺式小,因而反式较顺式稳定。
下表中归纳了顺反丁烯二烃的熔点、溶解度和偶极距 。
化学性质
顺反异构体具有相同的官能团,化学性质基本相同,但因有些反应与原子或原子团在空间的相对位置有关,反应速度也就有差别。 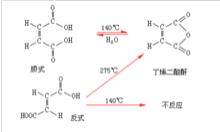
例如,顺-丁烯二酸的两个羧基处在双键的同侧距离比较近而容易发生脱水反应。反式的两个羧基即处在双键的异侧,距离较远,在同样温度下不起反应。但如热到较高的温度,反式先转变成顺式再脱水生成酸酐。
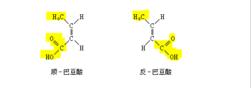
又如巴豆酸的两个异构体,用甲醇酯化时,反-巴豆酸的酯化速度较快,因反式的甲基和羧基处在双键的异侧,空间位阻较小,容易酯化。顺-巴豆酸的甲基和羧基处在双键的同侧,空间位阻较大,不易酯化。
紫外光谱
顺反异构多指双键或环上取代基在空间排列不同而形成的异构体。其紫外光谱有明显差别,一般反式异构体电子离预范围较大,键的张力较小,π—>π*跃迁位于长波端,吸收强度也较大。
反式二苯乙烯在乙醇溶液中出现3个吸收带,最大吸收波长为201.5nm。而顺式二苯乙烯在乙醇溶液中仅出现2条谱带,这是由于反式比顺式更加有效共轭。若α-甲基取代时,反式吸收带比顺式吸收带位于长波端,但α,α'-二甲基取代时,反式比顺式最大吸收波长位于较短波长端,这是由于这类化合物顺式更利于共轭。
肉桂酸异构体的紫外吸收光谱也有很大不同。反式肉桂酸为平面型结构,双键与处于同一平面的苯环容易π-π共轭。顺式肉桂酸中由于空间位阻,双键与苯环处于非平面,不易发生共轭。所以反式较顺式最大吸收波长位于长波端,摩尔吸收系数最大值高于顺式一倍。
红外光谱
有机化合物的红外光谱对于鉴别某种官能团的存在与否是相当有力的,而标志某官能团的特征吸收又与化合物的构造有着密切的联系,在有些场合,构造的差别甚至会使某一特征吸收消失。
例如,1,2一二氯乙烯的Vc=c吸收对于顺、 反异构体来讲是截然不同的:
反式1,2一二氯乙烯 Vc=c 无顺式1,2一二氯乙烯 Vc=c 1590cm-1(s)
这是因为反式异构体是一个对称的分子,μ=0。而这样的分子在红外光谱学中称为“红外失活的”,所以不产生吸收。这种对称性的影响在烯类化合物中的反映是比较明显的。如丙烯(CH3CH=CH2)这种不对称取代的烯可产生强的Vc=c吸收,而2—丁烯(CH3CH=CHCH3)其反式(Vc=c 1675cm-1)比顺式(Vc=c1660cm-1)的吸收波数稍高一些,但强度却相反,以致用该峰鉴别顺、反异构体无意义。但可借双键上所连氢的面外弯曲振动吸收来区别,这个峰在二者的鉴别上是相当有价值的。反式的面外吸收为1000-950cm-1, 而顺式的为725-675cm-1。
互相转换
在顺反异构体中,通常是反式比较稳定,而顺式较不稳定。
如将顺式异构体加热或受日光的作用,就容易转变成较稳定的反式异构体。例如顺-丁烯二酸加热就可转变
成反-丁烯二酸。 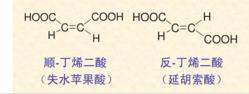
而反-丁烯二酸转变为顺式异构体较困难,比较好的方法是用紫外光照射,在紫外光照射下反式异构体吸收能量转变为顺式异构体,产品中通常存在顺式和反式混合物。 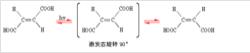
分析方法
高效液相色谱法
 顺反异构(3)HPLC法在顺反异构体药物的分离分析中应用广泛,其可与多种检测器联用,在分离分析高沸点、大分子、热稳定性差的化合物方面具有极大优势,而其对顺反异构体的分离选择性和检测精确度主要取决于选用合适的色谱柱和检测器。
顺反异构(3)HPLC法在顺反异构体药物的分离分析中应用广泛,其可与多种检测器联用,在分离分析高沸点、大分子、热稳定性差的化合物方面具有极大优势,而其对顺反异构体的分离选择性和检测精确度主要取决于选用合适的色谱柱和检测器。
毛细管电泳法
CE法对带电荷物质的分离效果显著,但有时为改善峰形或提高分离度,需在测试样品中添加合适的添加剂,如十二烷基磺酸钠(SDS)、β-环糊精等,或采用非水CE法。胡琴等(中国药学杂志,2001年)采用未涂层石英毛细管柱,以含0.5%羟丙基β-环糊精的50mmol·L-1磷酸二氢钠溶液(pH2.5)为运行缓冲液,于297nm波长下,分离检测盐酸多塞平的Z/E-异构体,其检测结果与HPLC法所得结果相近。随后,该研究小组又建立了非水CE法分离盐酸多塞平异构体,缓冲液为加入3.0%冰醋酸200mmol·L-1醋酸铵的甲醇-乙腈(95∶5)溶液,无需使用任何在毛细管区带电泳分离异构体时常用的添加剂即可在12min内完成分析,分析速度更快。
气相色谱法
GC法分离效率高,样品用量少,选择性好,可分离分析顺反异构体、旋光异构体等,常用于在实验温度下可气化且性质稳定的物质的分析,对于那些热不稳定或难以气化的物质,可通过化学衍生化方法使其达到GC分析的要求。多塞平的Z-和E-异构体具有不同的沸点,可选择GC法对二者进行分离,但因填充柱对多塞平存在吸附作用,使得色谱峰峰形较差,故研究者常选择使用毛细管色谱柱采用程序升温法,将HP-1毛细管柱温自起始温度90℃以30℃/min-1的速度升至200℃,然后以10℃/min-1的速度升至280℃,使马子宫和血浆中的多塞平及其代谢物的异构体在短短六分钟内得到分离。
活性应用
活性不同
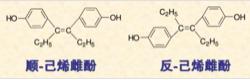
人工合成的乙烯雌酚是一种雌性激素,反式构型的生物活性比顺式构型的高7~10倍。
维生素A分子中所有的双键全部都为反式构型。 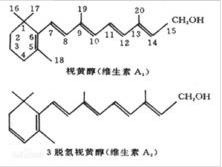
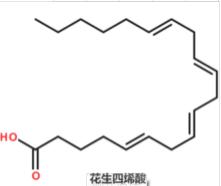
具有降血脂作用的亚油酸及花生四烯酸分子的碳碳双键都是顺式构型。 若改变上述化合物的构型,将导致生理活性的降低甚至丧失。
 [PtCl2(NH3)2]的顺-反异构体都是平面正方形,两者性质却不同,甚至在人体内的生理、病理作用也有所不同,如现已发现顺式[PtCl2(NH3)2]具有抑制肿瘤的作用,可作抗癌药物,而反式[PtCl2(NH3)2]则无此活性。
[PtCl2(NH3)2]的顺-反异构体都是平面正方形,两者性质却不同,甚至在人体内的生理、病理作用也有所不同,如现已发现顺式[PtCl2(NH3)2]具有抑制肿瘤的作用,可作抗癌药物,而反式[PtCl2(NH3)2]则无此活性。
药效不同
非甾体抗雌激素类药物他莫昔芬的2种构型具有完全相反的药理作用,其Z-异构体具有抗雌激素的作用,E-异构体则为雌激素兴奋剂。
氯哌噻吨的E-异构体可用作安定剂,而Z-异构体具有抗菌作用,对中枢神经疾病则无效。

-
DNA拓扑异构酶抑制剂
2025-06-12 09:51:43 查看详情 -
异构网络中间件与开放式API技术
2025-06-12 09:51:43 查看详情


 求购
求购








