- Sn1

Sn1
反应机理
 SN1与SN2的对比SN1反应机理是分步进行的,反应物首先解离为碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一步。当分子解离后,碳正离子马上与亲核试剂结合,速率极快,是快的一步。[1]
SN1与SN2的对比SN1反应机理是分步进行的,反应物首先解离为碳正离子与带负电荷的离去基团,这个过程需要能量,是控制反应速率的一步,即慢的一步。当分子解离后,碳正离子马上与亲核试剂结合,速率极快,是快的一步。[1]
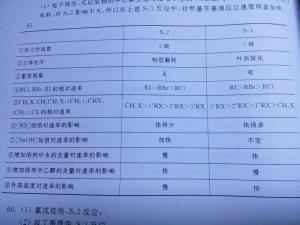
SN1反应速率只与一种反应物有关,是动力学一级反应。
在SN1反应中,试剂的亲核性并不重要,因为亲核试剂与底物的反应不是决定速率的一步,对反应速率的影响不大,同时碳正离子的反应性很高,不管试剂的亲核能力是大还是小,均能发生反应。比较起来,在SN2反应中,亲核试剂提供一对电子,与底物的碳原子成键,试剂的亲核性越强,成键越快。因此在SN2反应中试剂亲核性的强弱,对反应的影响很大。[2]
性质
1、SN1导致产物外消旋化;这是因为OHˉ可以从碳正离子的两面进攻,而生成两个构型相反的化合物。但其外消旋化产物大多数并非1:1生成,这可以从反应机理进行解释。有科学家认为,其机理应介于SN1与SN2之间。
2、SN1会导致产物的重排。这是因为碳正离子发生了向更稳定的碳正离子重排。
实例
下面以叔丁基溴在碱性水溶液中的水解为例子。
叔丁基溴的水解速率只与叔丁基溴的浓度都成正比(CH3)3CBr + OH-→ (CH3)3COH + Br-
v = k x [(CH3)3CBr]
首先,叔丁基溴在溶剂中水解为叔丁基正离子和Brˉ。过程为C-Br键逐渐伸长,电子云偏向Br原子,并使得中心碳原子上的正电荷逐渐增加,达到过渡态;再继续解离为对应离子,解离所需的能量由生成的离子发生的溶剂化作用补偿;接着,OHˉ进攻中心碳正离子,并经过过渡态,最后生成产物。
总结
影响SN反应活性的因素有:烃基的结构、离去基的种类、亲核试剂的亲核性、溶剂的极性等。
(1)不同烃基反应活性:叔>仲>伯。其中烯丙型和苄基型的卤代烃都有极高的活性。
(2)离去基团越易离去,反应的速度越高。其中I>Br>Cl。
(3)试剂亲核性对SN1反应无太大影响,但影响SN2反应。
(4)极性试剂有利于SN1反应

-
黄海纯电轿车Smile将于12月上市 29万元
2025-09-20 12:33:42 查看详情 -
Plus上市 别克昂科威S及昂科威S艾维亚将于7月29日上市
2025-09-20 12:33:42 查看详情 -
双12钜惠来袭 长城618宠粉节
2025-09-20 12:33:42 查看详情 -
全新紧凑型SUV/上半年上市 别克昂科拉PLUS最新谍照
2025-09-20 12:33:42 查看详情 -
成都丰田雷凌优惠达1.3万元 成都大众捷达最高优惠1.3万元
2025-09-20 12:33:42 查看详情 -
3将上市 17.58万
2025-09-20 12:33:42 查看详情 -
江铃宝典堪称商用皮卡常青树 江铃新宝典VS长城风骏7(图文)
2025-09-20 12:33:42 查看详情 -
江淮嘉悦X7正式上市 售5.97万元起/续航201km
2025-09-20 12:33:42 查看详情 -
380TSI劲擎智联版四驱车型上市 成都车展:雪铁龙C
2025-09-20 12:33:42 查看详情 -
小鹏全新P7i将于今日上市 售价119.8
2025-09-20 12:33:42 查看详情


 求购
求购

