- 先天性红细胞生成异常性贫血
- 首页
-
- 百科
-
- 发动机系统
-
- 先天性红细胞生成异常性贫血

先天性红细胞生成异常性贫血
概述
1951年,Wolf等首次报道一家族中母子3人同患“难治性贫血”且骨髓中有核红细胞呈多核、核碎裂和巨幼样改变。
1962年 Bergstrom等报道一家族中15例贫血患者,骨髓红系明显增生,有核红细胞巨幼样改变、多核、核碎裂易见,叶酸、维生素B12 铁剂治疗无效,靠输血维持,有遗传倾向,作者命名为遗传性良性网织红细胞增生性贫血。
1966年,Crookston等将此类贫血正式命名为CDA。1968年 Heimpel等根据血细胞骨髓形态和血清学检查,把CDA分为Ⅰ Ⅱ、Ⅲ 3型,之后,陆续有不同型CDA的报道。
流行病学
婴幼儿发病。Ⅲ型部分患者发病年龄达70多岁。男女发病机率相等。
病因:
大部分学者认为CDA Ⅰ型、Ⅱ型为常染色体隐性遗传,Ⅲ型为常染色体显性遗传。
发病机制:
发病机制至今不清楚。体外研究提示:各型CDA的造血异常主要在红细胞系本身,造血微环境及粒系、巨核系细胞无明显异常;形态上正常或无明显异常的红细胞与形态上明显异常的红细胞均来自同一克隆;核碎裂、多核可能与核蛋白合成异常、核膜异常或缺乏、核孔增宽、胞质和核内物质分布紊乱有关。
临床表现
1.CDAⅠ型 至今已报道30多例患者。兄弟姐妹可同时或相继发病,但未发现上下二代在同一家族发病。发病可在出生后(出现新生儿黄疸)、幼儿期,但多数至成人发病。查体可见脾大和黄疸,贫血为轻度。
2.CDA Ⅱ型 1969年Crookston又把此型命名为伴酸化血清试验阳性的遗传性原始红细胞多核症(hereditary erythroblast multinuclearity with positive acidified serum test,HEMPAS) 此型相对常见,现已报道55个家族84例患者。临床主要表现为正细胞性贫血、黄疸、肝脾肿大。贫血的程度因人而异 轻型患者(60%)幼年发病,血红蛋白可达110g/L,早期无贫血症状 到成年后才有贫血表现 约25%的患者病情相对较重,婴幼儿期就需定期输血维持。部分患者有特殊面容,颅骨双层板增宽。
3.CDA Ⅲ型 此型最早被报道,1951年Wolf等所描述的病例即属此型。现已报道4个家系23例患者。同一家系同代,不同代均可发病,提示为常染色体显性遗传。临床上表现为中~轻度正色素性贫血,常用促造血药物治疗无效,但一般病情稳定,且预后良好。查体可见黄疸,无肝、脾 淋巴结肿大。
除上述三型外,20世纪70年代以来,又有人报道了界于Ⅰ、Ⅱ型之间的CDA,还有人报道了所谓CDA Ⅳ型,其主要特点是:骨髓形态类似于CDAⅡ型,但“i”抗原正常。
病理表现
是有进行性严重贫血,呈正常红细胞性或轻度大红细胞性贫血,伴网织红细胞显著减少或缺如,周围血白细胞和血小板数正常或接近正常;骨髓有核细胞并不减少,粒细胞和巨核细胞系列增生正常,但幼红细胞系列显著减少,甚至完全缺乏。个别病例可见幼红细胞系列成熟停顿于早期阶段,出现原红细胞小簇且伴巨幼样变,但缺乏较成熟的幼红细胞。铁动力学测定,显示其本质是红细胞生成障碍。
(一)先天性纯红再障(diamond-blackfan贫血)90%于初生到1岁内起病,罕有2岁以后发病者,遗传规律尚不清,有家族性。患儿生长发育迟缓,少数也有轻度先天性畸形,如拇指畸形,和Fanconi贫血不同很少伴发恶性疾病。患者红系祖细胞不但数量缺乏,并且质有异常。HbF增多,胎儿膜抗原i持续存在,嘌呤解救途径酶活性增高,说明核酸合成有缺陷。患者淋巴细胞在体外可抑制正常红系祖细胞的生长。20%病例可自发缓解,60%患者对肾上腺皮质激素有效,无效者亦可做骨髓移植。
(二)急性获得性纯红再障在慢性溶血性贫血的病程中发生病毒感染,特别是人类微小病毒(parvovirus)B19感染,可选择性抑制红系祖细胞,发生急性纯红再障,又称溶血性贫血的再生障碍性危象;某些病例在病毒感染后发生造血功能暂时停顿,导致全血细胞减少,骨髓中出现巨原红细胞,又称急性造血停滞。急性纯红再障也可发生在1~4岁小儿,数周后自愈,并无感染因素,称儿童暂时性幼红细胞减少症。急性纯红再障尚见于病毒性肝炎和某些药物诱发,如苯妥因、硫唑嘌呤、氯霉素、异烟肼和普鲁卡因胺等,停药后大多数病例会完全恢复。
(三)慢性获得性纯红再障主要见于成人。50%患者伴有胸腺瘤,仅5%胸腺瘤患者有纯红再障;这些胸腺瘤多数系良性,70%为纺锤细胞型,少数为恶性;女性多见(女∶男为3~4.5∶1)。少数尚可继发于某些自身免疫性疾病如系统性红斑狼疮和类风湿关节炎,及某些肿瘤如慢性淋巴细胞白血病、慢性粒细胞白血病、淋巴瘤、免疫母细胞淋巴结病、胆道腺癌、甲状腺癌、支气管肺癌及乳腺癌等。原因不明者称原发性获得性纯红再障,系多种免疫机制引起幼红细胞生成抑制,患者血清中存在抗幼红细胞抗体,抗红细胞生成素抗体或具有抑制性T淋巴细胞等。患者常伴多种免疫学异常如免疫球蛋白增高或降低、单株免疫球蛋白及血清多种抗体阳性,如冷凝集素、冷溶血素、嗜异抗体、抗核抗体等。抗人球蛋白试验等阳性。个别患者可伴多种内分泌腺功能减低。不伴胸腺瘤的纯红再障多见于男性(男∶女为2∶1)。
诊断
CDA的诊断主要依据以下几点:良性、正色素性、难治性单纯贫血伴持续或间断性黄疸;网织红细胞不高;骨髓红系明显增生,且有典型的形态学改变,粒系、巨核系细胞正常;可有地中海贫血样红细胞珠蛋白肽链的异常、HEMPAS抗原和i抗原的变化;可有阳性家族史。
鉴别诊断:
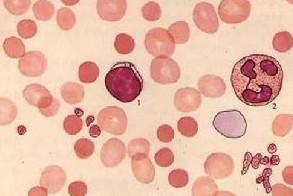 先天性红细胞生成异常性贫血1.CDA应与地中海贫血鉴别 因两者都有家族性,都有单纯贫血、黄疸及珠蛋白肽链的异常。但地中海贫血患者可有所谓“地贫面容”、网织红细胞增高,红细胞寿命明显缩短、切脾治疗效果佳等特点;而CDA可有染色质“桥”、红细胞“鬼影”、巨大/多核红细胞以及HEMPAS抗原和i抗原的改变等,借此可区分两种疾病 当然,如果将来对典型CDA患者做红细胞基因检查,无疑将更有助于鉴别之。
先天性红细胞生成异常性贫血1.CDA应与地中海贫血鉴别 因两者都有家族性,都有单纯贫血、黄疸及珠蛋白肽链的异常。但地中海贫血患者可有所谓“地贫面容”、网织红细胞增高,红细胞寿命明显缩短、切脾治疗效果佳等特点;而CDA可有染色质“桥”、红细胞“鬼影”、巨大/多核红细胞以及HEMPAS抗原和i抗原的改变等,借此可区分两种疾病 当然,如果将来对典型CDA患者做红细胞基因检查,无疑将更有助于鉴别之。
2.CDAⅡ型应与不发作型阵发性睡眠性血红蛋白症(PNH)鉴别 因两者都可出现酸溶血试验阳性,但PNH红细胞对补体敏感的机制与CDA截然不同:PNH是由于磷脂酰肌醇糖苷A类(PIG-A)基因异常导致血细胞膜上磷脂酰肌醇(GPI)锚接蛋白量少,进而影响补体调节;而CDA却是由于HEMPAS抗原。故可通过测定红细胞膜上的补体调节蛋白(DAF、CD59)鉴别之。另外,PNH病在造血干细胞,特别是不发作型,往往表现为全血细胞减少和骨髓增生不良,借此也可与CDAⅡ型相区别。
3.CDA与巨幼细胞贫血的鉴别 主要靠病史(包括营养史和家族史)和叶酸或(和)维生素B12的治疗反应。CDA与骨髓增生异常综合征和白血病的鉴别主要依据后两者为恶性病,往往累及全髓(全血细胞),且有病理、组化、染色体甚至癌基因的异常等。
实验室检查:
1.CDAⅠ型
(1)外周血:细胞大小不均 异形、点彩、卡波环均很明显,白细胞和血小板均正常。
(2)骨髓象:红系明显增生,可见双核红细胞,多核红细胞及巨大红细胞,特征性改变为Feulgen试验阳性的连接两个有核红细胞的核间染色质桥。在电镜下 染色质呈海绵状,密度不均匀,胞核呈“干酪”样改变。
(3)血清间接胆红素可增高:尿胆原增高。
(4)血清铁增高或正常:红细胞珠蛋白α与非α肽链比值增高,可见包涵小体,其他特异性溶血性贫血的病因学检查皆阴性。
2.CDAⅡ型
(1)外周血:同样可见红细胞大小不均、异形红细胞、点彩红细胞,一位相显微镜下,可见红细胞特征性改变,即红细胞“鬼影”;电镜下观察“鬼影”区域由双层膜组成。
(2)骨髓象:增生明显活跃,双核红细胞占红系10%~40% 多为幼红;与Ⅰ型不同的是很少见巨大红细胞,有些患者可见网状细胞吞噬红细胞现象。
(3)成熟红细胞出现PNH红细胞样改变:对酸化血清敏感,已证明这是因为CDAⅡ型红细胞膜表面存在HEMPAS抗原,抗原-抗体反应激活经典补体途径所致。但其对酸化血清的敏感性比PNH差,蔗糖试验从不发生溶血。进一步的研究还表明,HEMPAS抗原是由N-乙酰葡萄糖胺转移酶Ⅱ遗传异常所致,因为此酶的异常导致组成细胞膜糖蛋白糖类部分异常,特别是带3、带4 5,可能还有糖蛋白A的异常。另外一血清学异常是红细胞表面“i”抗原增加。
3.CDA Ⅲ型
(1)外周血:成熟红细胞明显大小不均,可见巨大红细胞 有核红细胞,网织红细胞计数正常或偏低,白细胞及血小板正常。
(2)骨髓象:红系明显增生,各阶段有核红细胞均可见巨大改变,部分有核红细胞胞体直径达50~60μm,含有10~12个核仁,二核 三核、多核红细胞、核碎裂很常见,粒系、巨核系细胞形态大致正常。
(3)血清铁水平升高:血清间接胆红素增高,尿胆原增高。
(4)红细胞珠蛋白β肽链增多:可见包涵体,红细胞寿命、盐水渗透脆性试验、酸化血清溶血试验、Coombs试验皆正常。
其它辅助检查:
根据病情选择B超、心电图、X线等检查。
治疗及预后
治疗:
铁剂、叶酸、维生素B12及脾切除等对CDA均无明显疗效,输浓缩红细胞是惟一的纠正贫血疗法。并发症主要为输血引起的血色病或切脾后继发感染。
预后:
先天性红细胞生成异常性贫血预后好。

-
来看看江铃福特领睿 二手残值率领先同级
2025-11-03 17:28:06 查看详情 -
奇瑞5亿钜惠优先享不停 迈锐宝国庆车展大放价
2025-11-03 17:28:06 查看详情 -
BMW116i都市版首付三成 运动先锋
2025-11-03 17:28:06 查看详情 -
——全家细品新BMW 运动先锋
2025-11-03 17:28:06 查看详情 -
全新BMW1系上市发布会在乐山举行 运动先锋
2025-11-03 17:28:06 查看详情 -
3缸BMW将出炉 运动先锋
2025-11-03 17:28:06 查看详情 -
Autotimes试驾宝马BMW新1系 运动先锋
2025-11-03 17:28:06 查看详情 -
BMW全新M3、M4实拍图解 运动先锋
2025-11-03 17:28:06 查看详情 -
创新BMW 运动先锋
2025-11-03 17:28:06 查看详情


 求购
求购

