- α螺旋

α螺旋
概述
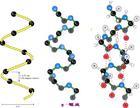 α-螺旋(α-helix):蛋白质中常见的二级结构,肽链主链绕假想的中心轴盘绕成螺旋状,一般都是右手螺旋结构,螺旋是靠链内氢键维持的。每个氨基酸残基(第n个)的羰基与多肽链C端方向的第4个残基(第4+n个)的酰胺氮形成氢键。在古典的右手α-螺旋结构中,螺距为0.54nm,每一圈含有3.6个氨基酸残基,每个残基沿着螺旋的长轴上升0.15nm。
α-螺旋(α-helix):蛋白质中常见的二级结构,肽链主链绕假想的中心轴盘绕成螺旋状,一般都是右手螺旋结构,螺旋是靠链内氢键维持的。每个氨基酸残基(第n个)的羰基与多肽链C端方向的第4个残基(第4+n个)的酰胺氮形成氢键。在古典的右手α-螺旋结构中,螺距为0.54nm,每一圈含有3.6个氨基酸残基,每个残基沿着螺旋的长轴上升0.15nm。
详解
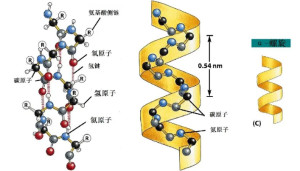 α螺旋(3)α螺旋是一种最常见的二级结构,最先由Linus Pauling和Robert Corey于1951年提出,其主要内容是:
α螺旋(3)α螺旋是一种最常见的二级结构,最先由Linus Pauling和Robert Corey于1951年提出,其主要内容是:
①肽链骨架围绕一个轴以螺旋的方式伸展;
②螺旋形成是自发的,肽链骨架上由n位氨基酸残基上的-C=O与n+4位残基上的-NH之间形成的氢键起着稳定的作用;被氢键封闭的环含有13个原子,因此α螺旋也称为3.6/13螺旋;
③每隔3.6个残基,螺旋上升一圈;每一个氨基酸残基环绕螺旋轴100°,螺距为0.54nm,即每个氨基酸残基沿轴上升0.15nm;螺旋的半径是0.23nm;Φ角和Ψ角分别为-57°和-47°;
④α螺旋有左手和右手之分,但蛋白质中的α螺旋主要是右手螺旋;
⑤氨基酸残基的R基团位于螺旋的外侧,并不参与螺旋的形成,但其大小、形状和带电状态却能影响螺旋的形成和稳定。
功能
α-螺旋在DNA结合基序(DNA binding motifs)中有非常重要的作用,比如在锌指结构,亮氨酸拉链,螺旋-转角-螺旋等基序中都含有α-螺旋。这是因为α-螺旋的直径为1.2nm,正好和B-DNA大沟的直径相等,所以能够和B型DNA紧密结合。
稳定性
原因
α-螺旋靠氢键维持稳定
影响因素
1.Pro(及Hpro)使α-螺旋中断,产生“结节”。Pro的α-碳原子参与吡咯环的形成,使α-碳原子—N键不能旋转,Gly绕α-碳原子的自由度更大,所以大多α-螺旋起始或中止于Gly,还有Tyr和Ser等。
2.侧链较大的氨基酸相邻时影响生成两个“α-碳上分支”(α-碳原子上除了H,还有两个其他基团接在上面,如Thr,Ile(ile),Val等)
3.带相同电荷的氨基酸相邻,使α-螺旋趋于解体
(概述图片来源)

-
六道·超大玉螺旋手里剑
2025-09-21 03:03:13 查看详情 -
DQG型螺旋伞齿轮行星齿轮减速机
2025-09-21 03:03:13 查看详情


 求购
求购







