- 多核金属

多核金属
简介
 最早的多核金属中的金属为四价金属元素,例如多硅烷、多锗烷、多锡烷和多铅烷,可用MnR2n+2通式表达(M为金属,R为烷基)。成链的金属原子数随着周期数的增大而减少,五价金属原子之间成键倾向大大减小。
最早的多核金属中的金属为四价金属元素,例如多硅烷、多锗烷、多锡烷和多铅烷,可用MnR2n+2通式表达(M为金属,R为烷基)。成链的金属原子数随着周期数的增大而减少,五价金属原子之间成键倾向大大减小。
过渡金属(见过渡元素)多核化合物除稀土金属(见稀土元素)外,其他元素的多核金属已经合成出来,例如羰基金属原子簇(见原子簇金属化合物)等。根据原子之间的键距和红外光谱特征频率,同种金属原子之间相互成键,可以区分为M-M、M匉M、M呏M或多重金属键,例如:
单键的力常数为0.5~1.5微达因/埃,双键的则为2.7微达因/埃,多重键达到3.5~4.5微达因/埃。
不同的金属原子之间成键多半是单键形式,例如:Cp(CO)3W - Mo(CO)3Cp、 Cp(CO)2Fe - Mn(CO)5、Cp(CO)2Fe-Co(CO)4,Cp为环戊二烯基。每个金属原子都能达到稳定的18电子构型。
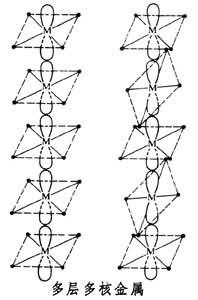
金属原子之间通过桥连原子或多层夹心配位体可以获得多核金属化合物,它们不含M-M键。铂系金属络合物(见配位化合物)的成键方式为正方形平面络合物,如双(二甲基乙二肟)镍(Ⅱ)、【四氰基合铂(Ⅱ)】2-,金属原子之间键距接近2.85~3.25埃,从而形成M→M配键,四配位的金属分子平面互相重叠,成为以金属为脊椎的长链(见图),而且由于分子之间紧密堆积,成为导电体。这种金属之间的相互作用以铂为最大,电导率在金属脊椎方向达到2×102西/厘米。称为一维导体。
金属 - 简介
金属 jīn shǔ 英语:metal(s)
定义
通常把元素周期表中具有金属光泽、可塑性、导电性及导热性良好的化学元素称为金属。在元素周期表中,金属元素有80多种,其它元素称为非金属。金属的分类是按历史上形成的工业分类法,这种分类法虽然没有严格的科学论证,但一直沿用到现代。
金属最突出的特性是它们的容易失去电子的倾向。因此,从化学角度看,金属是指在溶液中容易生成正离子的化学元素,其氧化物与水结合形成氢氧化物而不形成相应的酸。金属之间在化学上的差别主要表现在电子序方面,许多化学反应,特别是氧化还原反应,决定与其电极电位的正负及其数值大小。
从物理角度看,由于金属的原子的外层结构中都含有游离的或易激化的电子,因而具有一系列金属特性(金属性)。
其它
在自然界中,绝大多数金属以化合态存在,少数金属例如金、铂、银、铋以游离态存在。金属矿物多数是氧化物及硫化物。其他存在形式有氯化物、硫酸盐、碳酸盐及硅酸盐。金属之间的连结是金属键,因此随意更换位置都可再重新建立连结,这也是金属伸展性良好的原因。金属元素在化合物中通常只显正价。金属中延展性最好的是金(Au),常温下导电好的依次是银(Ag)、铜(Cu)、铝(Al)等。
金属 - 金属元素在周期表中的位置
在元素周期表中被认为是金属的元素如下 :
—所有2A和2A族元素;
—3A族(Al、Ga、In、Tl)、4A族(Sn、Pb)和5A(Bi)中的较重元素;
—所有过渡金属(B副族) ;
—所有镧系和锕系元素。
在已发现的112种元素, 上述金属共占90种。位于“硼-砹分界线”的左下方,在s区、p区、d区、f区等5个区域都有金属元素,过渡元素全部是金属元素。

-
呼和浩特探岳现金优惠3.5万 成都丰田锐志最高优惠2.2万
2025-09-20 13:38:29 查看详情 -
西安大众速腾现金优惠2.3万 成都沃尔沃XC90优惠三万元
2025-09-20 13:38:29 查看详情 -
西安大众速腾现金优惠2.3万 驾驭快感
2025-09-20 13:38:29 查看详情 -
呼和浩特探岳现金优惠3.5万 再送装潢礼包
2025-09-20 13:38:29 查看详情 -
重庆林肯Z现金优惠1.2万元 成都丰田锐志购车优惠2.4万元
2025-09-20 13:38:29 查看详情 -
成都丰田亚洲狮现金优惠3万元 成都丰田锐志购车优惠2.4万元
2025-09-20 13:38:29 查看详情 -
珠海大众宝来现金优惠2.7万 外观流畅
2025-09-20 13:38:29 查看详情 -
成都标致307两厢优惠5千元 长沙现代悦动现金优惠1.2万
2025-09-20 13:38:29 查看详情 -
大连沃尔沃S90现金优惠7.2万 购S80送全购置税加全险
2025-09-20 13:38:29 查看详情 -
长城金刚炮AT车型将于3月2日上市 6.89万
2025-09-20 13:38:29 查看详情


 求购
求购

