- 钙

钙
研究简史
 钙
钙
长时期里,化学家们将从含碳酸钙的石灰石焙烧获得的钙的氧化物当作是不可再分割的物质。在1789年拉瓦锡发表的元素表中就列有它。但戴维不顾这些,在1808年开始对氧化钙进行电解。戴维刚开始选用的方法并不理想,所以无法将金属钙分离出来。到1808年5月,戴维从贝齐里乌斯和瑞典皇家医生蓬丁共同电解生石灰和水银的混合物取得钙的实验中获得了启发。他将湿润的生石灰和氧化汞按3比1的比例混合后,放置在一铂片上,与电池的正极相接,然后又在混合物中作一洼穴,灌入水银,插入一铂丝,与电池的负极相接,得到较大量钙汞合金。把钙汞合金经蒸馏后得到了银白色的金属钙。从此钙被确定为元素,并被命名为calcium,元素符号是Ca。calcium来自拉丁文中表示生石灰的词calx。
 金属钙元素发布:地壳中钙含量为4.15%,占第五位。主要的含钙矿物有石灰石CaCO3、白云石CaCO3·MgCO3、石膏CaSO4·2H2O、萤石CaF2、磷灰石Ca5(PO4)3F等。蛋壳、珍珠、珊瑚、一些动物的壳体和土壤中都含有钙。海水中氯化钙占0.15%。
金属钙元素发布:地壳中钙含量为4.15%,占第五位。主要的含钙矿物有石灰石CaCO3、白云石CaCO3·MgCO3、石膏CaSO4·2H2O、萤石CaF2、磷灰石Ca5(PO4)3F等。蛋壳、珍珠、珊瑚、一些动物的壳体和土壤中都含有钙。海水中氯化钙占0.15%。
理化性质
物理性质
元素周期表第Ⅱ族主族。[4]银白色稍软的![]() 钙加热时与二氧化碳化学反应方程式金属,有光泽。不溶于苯,微溶于醇,溶于酸、液氨。[5]
钙加热时与二氧化碳化学反应方程式金属,有光泽。不溶于苯,微溶于醇,溶于酸、液氨。[5]
电离能 (kJ /mol):
晶胞参数:
| a = 558.84 pm |
| b = 558.84 pm |
| c = 558.84 pm |
| α = 90° |
| β = 90° |
| γ = 90° |
主要吸收线及其主要参数:
| λ(nm) | f | W | F | S* | CL | R·S |
| 422.7 | 1.49 | 0.7 | A-A | 0.06 | 0.005 | |
| 422.7 | 0.7 | N-A | 0.03 | 0.005 | 1.0 | |
| 239.9 | 0.037 | 0.7 | N-A | 20 | 120 | |
| 445.5 | 0.7 | N-A |
[6]
λ:波长[6]
f:振子强度[6]
W:单色器光谱通带[6]
N-A(氧化亚氮-乙炔焰)[6]
S*:元素的特征浓度(1%吸收灵敏度)[6]
CL:元素的检测极限[6]
R·S:同一元素主要吸收线间的相对灵敏度[6]
F:火焰类型[6]
| CAS NO | 7440-70-2 |
| EINECS | 231-179-5 |
| 熔点 | 1115 K(842 °C,1548 °F) |
| 密度 | 1.55 |
| 沸点 | 1757 K(1484 °C,2703 °F) |
| 氧化态 | Main Ca+2 Other |
| 莫氏硬度 | 1.75 |
| 氧化物离解能(Do) | 5.0(eV) |
| 元素电离能(Ei) | 6.11(eV) |
| 原子体积(立方厘米/摩尔) | 25.9 |
| 元素在海水中的含量(ppm) | 390 |
| 地壳中含量(ppm) | 41000 |
| 元素在太阳中的含量:(ppm) | 70 |
同位素:
| 符号 | 质子 | 中子 | 质量(原子质量单位) | 半衰期 | 原子核自旋 | 相对丰度 | 相对丰度的变化率 |
|---|---|---|---|---|---|---|---|
| 34Ca | 20 | 14 | 34.01412(32)# | <35 ns | 0+ | ||
| 35Ca | 20 | 15 | 35.00494(21)# | 25.7(2) ms | 1/2+# | ||
| 36Ca | 20 | 16 | 35.99309(4) | 102(2) ms | 0+ | ||
| 37Ca | 20 | 17 | 36.985870(24) | 181.1(10) ms | (3/2+) | ||
| 38Ca | 20 | 18 | 37.976318(5) | 440(8) ms | 0+ | ||
| 39Ca | 20 | 19 | 38.9707197(20) | 859.6(14) ms | 3/2+ | ||
| 40Ca | 20 | 20 | 39.96259098(22) | 稳定 [>5.9×1021a] | 0+ | 0.96941(156) | 0.96933-0.96947 |
| 41Ca | 20 | 21 | 40.96227806(26) | 1.02(7)×105a | 7/2- | ||
| 42Ca | 20 | 22 | 41.95861801(27) | 稳定 | 0+ | 0.00647(23) | 0.00646-0.00648 |
| 43Ca | 20 | 23 | 42.9587666(3) | 稳定 | 7/2- | 0.00135(10) | 0.00135-0.00135 |
| 44Ca | 20 | 24 | 43.9554818(4) | 稳定 | 0+ | 0.02086(110) | 0.02082-0.02092 |
| 45Ca | 20 | 25 | 44.9561866(4) | 162.67(25) d | 7/2- | ||
| 46Ca | 20 | 26 | 45.9536926(24) | 稳定 [>100×1015a] | 0+ | 0.00004(3) | 0.00004-0.00004 |
| 47Ca | 20 | 27 | 46.9545460(24) | 4.536(3) d | 7/2- | ||
| 48Ca | 20 | 28 | 47.952534(4) | 4.3(38)×1021 a | 0+ | 0.00187(21) | 0.00186-0.00188 |
| 49Ca | 20 | 29 | 48.955674(4) | 8.718(6) min | 3/2- | ||
| 50Ca | 20 | 30 | 49.957519(10) | 13.9(6) s | 0+ | ||
| 51Ca | 20 | 31 | 50.9615(1) | 10.0(8) s | (3/2-)# | ||
| 52Ca | 20 | 32 | 51.96510(75) | 4.6(3) s | 0+ | ||
| 53Ca | 20 | 33 | 52.97005(54)# | 90(15) ms | 3/2-# | ||
| 54Ca | 20 | 34 | 53.97435(75)# | 50# ms [>300 ns] | 0+ | ||
| 55Ca | 20 | 35 | 54.98055(75)# | 30# ms [>300 ns] | 5/2-# | ||
| 56Ca | 20 | 36 | 55.98557(97)# | 10# ms [>300 ns] | 0+ | ||
| 57Ca | 20 | 37 | 56.99236(107)# | 5# ms | 5/2-# |
备注:1.画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
2.钙(原子质量单位:40.078(4) )共有个24同位素,其中有5个同位素是稳定的。
化学性质
| a = 558.84 pm |
| b = 558.84 pm |
| c = 558.84 pm |
| α = 90° |
| β = 90° |
| γ = 90° |
制备方法
| λ(nm) | f | W | F | S* | CL | R·S |
| 422.7 | 1.49 | 0.7 | A-A | 0.06 | 0.005 | |
| 422.7 | 0.7 | N-A | 0.03 | 0.005 | 1.0 | |
| 239.9 | 0.037 | 0.7 | N-A | 20 | 120 | |
| 445.5 | 0.7 | N-A |
应用领域
| CAS NO | 7440-70-2 |
| EINECS | 231-179-5 |
| 熔点 | 1115 K(842 °C,1548 °F) |
| 密度 | 1.55 |
| 沸点 | 1757 K(1484 °C,2703 °F) |
| 氧化态 | Main Ca+2 Other |
| 莫氏硬度 | 1.75 |
| 氧化物离解能(Do) | 5.0(eV) |
| 元素电离能(Ei) | 6.11(eV) |
| 原子体积(立方厘米/摩尔) | 25.9 |
| 元素在海水中的含量(ppm) | 390 |
| 地壳中含量(ppm) | 41000 |
| 元素在太阳中的含量:(ppm) | 70 |
工业领域
| 符号 | 质子 | 中子 | 质量(原子质量单位) | 半衰期 | 原子核自旋 | 相对丰度 | 相对丰度的变化率 |
|---|---|---|---|---|---|---|---|
| 34Ca | 20 | 14 | 34.01412(32)# | <35 ns | 0+ | ||
| 35Ca | 20 | 15 | 35.00494(21)# | 25.7(2) ms | 1/2+# | ||
| 36Ca | 20 | 16 | 35.99309(4) | 102(2) ms | 0+ | ||
| 37Ca | 20 | 17 | 36.985870(24) | 181.1(10) ms | (3/2+) | ||
| 38Ca | 20 | 18 | 37.976318(5) | 440(8) ms | 0+ | ||
| 39Ca | 20 | 19 | 38.9707197(20) | 859.6(14) ms | 3/2+ | ||
| 40Ca | 20 | 20 | 39.96259098(22) | 稳定 [>5.9×1021a] | 0+ | 0.96941(156) | 0.96933-0.96947 |
| 41Ca | 20 | 21 | 40.96227806(26) | 1.02(7)×105a | 7/2- | ||
| 42Ca | 20 | 22 | 41.95861801(27) | 稳定 | 0+ | 0.00647(23) | 0.00646-0.00648 |
| 43Ca | 20 | 23 | 42.9587666(3) | 稳定 | 7/2- | 0.00135(10) | 0.00135-0.00135 |
| 44Ca | 20 | 24 | 43.9554818(4) | 稳定 | 0+ | 0.02086(110) | 0.02082-0.02092 |
| 45Ca | 20 | 25 | 44.9561866(4) | 162.67(25) d | 7/2- | ||
| 46Ca | 20 | 26 | 45.9536926(24) | 稳定 [>100×1015a] | 0+ | 0.00004(3) | 0.00004-0.00004 |
| 47Ca | 20 | 27 | 46.9545460(24) | 4.536(3) d | 7/2- | ||
| 48Ca | 20 | 28 | 47.952534(4) | 4.3(38)×1021 a | 0+ | 0.00187(21) | 0.00186-0.00188 |
| 49Ca | 20 | 29 | 48.955674(4) | 8.718(6) min | 3/2- | ||
| 50Ca | 20 | 30 | 49.957519(10) | 13.9(6) s | 0+ | ||
| 51Ca | 20 | 31 | 50.9615(1) | 10.0(8) s | (3/2-)# | ||
| 52Ca | 20 | 32 | 51.96510(75) | 4.6(3) s | 0+ | ||
| 53Ca | 20 | 33 | 52.97005(54)# | 90(15) ms | 3/2-# | ||
| 54Ca | 20 | 34 | 53.97435(75)# | 50# ms [>300 ns] | 0+ | ||
| 55Ca | 20 | 35 | 54.98055(75)# | 30# ms [>300 ns] | 5/2-# | ||
| 56Ca | 20 | 36 | 55.98557(97)# | 10# ms [>300 ns] | 0+ | ||
| 57Ca | 20 | 37 | 56.99236(107)# | 5# ms | 5/2-# |
生物领域
 钙片图加热时与大多数非金属直接反应,如与硫、氮、碳、氢反应生成硫化钙CaS、氮化钙Ca3N2、碳化钙CaC2和氢化钙CaH2。加热时与二氧化碳反应。
钙片图加热时与大多数非金属直接反应,如与硫、氮、碳、氢反应生成硫化钙CaS、氮化钙Ca3N2、碳化钙CaC2和氢化钙CaH2。加热时与二氧化碳反应。
化学性质活泼,在空气中表面上能形成一层氧化物或氮化物薄膜,可减缓进一步腐蚀。可跟氧化合生成氧化钙,跟氮化合生成氮化钙Ca3N2,跟氟、氯、溴、碘等化合生成相应卤化物,跟氢气在400℃催化剂作用下生成氢化钙。常温下跟水反应生成氢氧化钙并放出氢气,跟盐酸稀硫酸等反应生成盐和氢气,跟碳在高温下反应生成碳化钙CaC2。加热时几乎能还原所有金属氧化物,在熔融时也能还原许多金属氯化物。[7]
化合物:钙的重要化合物有氢化钙、氧化钙、过氧化钙、氯化钙、氟化钙、碳化钙、氢氧化钙、氰氨化钙、碳酸钙、次氯酸钙、硫酸钙等。钙与液氨反应生成Ca(NH3)6,是一种具金属光泽的导电固体;钙离子可以生成螯合物[CaEDTA]2-(EDTA为乙二胺四乙酸),钙离子与含有N、O配原子的化合物可生成配合物,与冠醚、穴醚生成大环配合物。氟化钙CaF2为白色晶体或粉末,密度3.18克/立方厘米,熔点1,418℃,沸点2,533.4℃,难溶于水,溶于强浓无机酸放出氟化氢。自然界的氟化钙矿物为萤石或氟石,常呈灰、黄、绿、紫等色。工业上常用氢氧化钙与氢氟酸中和制备氟化钙;用水吸收生产钙镁磷肥时的废气再用石灰乳中和,亦可制得氟化钙。过氧化钙CaO2为黄白色晶体,属四方晶系,密度2.9克/立方厘米,加热至275℃爆炸分解;易潮解,微溶于水,与稀硫酸反应生成过氧化氢。向氯化钙水溶液加入过氧化氢和氨水,或将氢氧化钙、氯化铵溶于水,再加入过氧化氢,两反应皆在0℃左右进行,并析出CaO2·8H2O晶体;在150~200℃脱水干燥,可得到无水过氧化钙。
常温下与水发生剧烈反应,生成氢氧化钙(石灰)、氢气水。
Ca+2H2O====Ca(OH)2+H2↑(置换反应)
溶于酸,能分解水而放出氢。[8]
电子排布式:1s22s22p63s23p64s2
钙的有关化学方程式:
Ca+2HCl=CaCl2+H2↑(置换反应)
N2+3Ca=Ca3N2(化合反应)
3C+CaO=CaC2+CO ↑(氧化还原反应)
CO2+Ca(OH)2(过量)=CaCO3↓+H2O(复分解反应)
2CO2(过量)+Ca(OH)2=Ca(HCO3)2(化合反应)
SO2+Ca(OH)2===CaSO3+H2O(复分解反应)
SO3+Ca(OH)2=CaSO4↓+H2O(复分解反应)
2HNO3+CaCO3=Ca(NO3)2+H2O+CO2↑(复分解反应)
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(氧化还原反应)
CaH2+2H2O=Ca(OH)2+2H2↑(氧化还原反应)
2HF+CaCl2=CaF2+2HCl(复分解反应)
SiO2+CaO=CaSiO3(化合反应)
SiO2+CaCO3=CaSiO3+CO2↑(复分解反应)
Ca(HCO3)2=加热=CaCO3+H2O+CO2↑(分解反应)
CaCO3=高温=CaO+CO2↑(分解反应)
| 质子数 | 20 |
| 中子数 | 20 |
| 原子序数 | 20 |
| 核电荷数 | 20 |
| 所属周期 | 3 |
| 所属族数 | IIA |
| 电子层分布 | 2-8-8-2 |
| 电子层 | K-L-M-N |
医学领域
| 质子数 | 20 |
| 中子数 | 20 |
| 原子序数 | 20 |
| 核电荷数 | 20 |
| 所属周期 | 3 |
| 所属族数 | IIA |
| 电子层分布 | 2-8-8-2 |
| 电子层 | K-L-M-N |
食谱菜谱
![]() 钙与氯化铽化学反应方程式1.电解法将干燥后的无水氯化钙投入电解槽内,用氧炔焰喷熔电解槽内阳极(石墨)旁的原料,即开冷却水,将阴极(圆钢)放下,接触料液表面,通入电流。使熔融的料液流向阴极接通电路。待原料大部分熔融后继续再加新料,直到离槽沿2~3 cm,温度正常为止。 金属钙沉积在阴极上,电流为350~450 A,电压为20~25 V,在敲击阴极上沉积的金属钙以前,应将电流降低50~100A。待敲下的金属钙放入油中后,阴极再接触电解质液面,再使电流升高50~100 A,为保持电解槽温度,应陆续加料。氯气由阳极逸出,回收利用。
钙与氯化铽化学反应方程式1.电解法将干燥后的无水氯化钙投入电解槽内,用氧炔焰喷熔电解槽内阳极(石墨)旁的原料,即开冷却水,将阴极(圆钢)放下,接触料液表面,通入电流。使熔融的料液流向阴极接通电路。待原料大部分熔融后继续再加新料,直到离槽沿2~3 cm,温度正常为止。 金属钙沉积在阴极上,电流为350~450 A,电压为20~25 V,在敲击阴极上沉积的金属钙以前,应将电流降低50~100A。待敲下的金属钙放入油中后,阴极再接触电解质液面,再使电流升高50~100 A,为保持电解槽温度,应陆续加料。氯气由阳极逸出,回收利用。
CaCl2=(通电)Ca+Cl2↑(得到钙与副产品氯气。)
2.钙可由电解法及铝热还原法制得。电解氯化钙的熔融盐,产品的纯度仅为90%。 热还原法是用铝在高温下还原氧化钙,产品纯度较高(99%)。其工艺过程也比较简单,是近几年采用的方法。 首先由CaCO3焙烧制得CaO。铝最好是小颗粒或薄片。氧化钙与铝的摩尔比为3∶2。配料混合后制成料坯。手动油压机的压力可低于制造镁硅料坯的压力。
3.金属钙可采用在780~800℃电解熔融氯化钙。电解槽可以为石墨坩埚,阳极采用石墨,以铁棒或石墨棒为阴极。阴极的电流密度保持100A/cm2。随着金属钙的析出,将阴极逐渐提高。金属钙上遮盖了一层在空气中凝固了的熔融氯化钙而防止氧化。制得钙纯度为98%~99%,杂质为铁、硅、铝、痕量的炭和若干氯。[9]
4.先由石灰石与盐酸反应得到氯化钙:
CaCO3+2HCl=CaCl2+H2O+CO2↑
日常饮食
注意事项
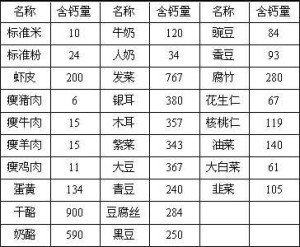 常用食物中的钙含量(mg/100 g)用于与铝、铜、铅制合金,也用作制铍的还原剂、合金的脱氧剂、油脂脱氢等。[10]
常用食物中的钙含量(mg/100 g)用于与铝、铜、铅制合金,也用作制铍的还原剂、合金的脱氧剂、油脂脱氢等。[10]
用作合金的脱氧剂、油类的脱水剂、冶金的还原剂、铁和铁合金的脱硫与脱碳剂以及电子管中的吸气剂等。
安全术语
 佝偻病患者钙用作高温热还原剂,从氧化物、卤化物制取金属铬、钍、铀、稀土元素、锆,以及磁性材料钐钴合金、吸氢材料镧镍合金和钛镍合金等。Ca–Si合金加入钢中,可以阻止碳化物生成。含钙0.04%的铅钙合金有较高硬度和耐蚀性能,用作电缆线外皮和蓄电池铅板;铝合金中加入钙,可增强塑性。钙还用作冶炼锡青铜、镍、钢的脱氧剂,电子管和电视显像管中的消气剂、有机溶剂的脱水剂、石油精制的脱硫剂、纯制惰性气体(如氦)的除氮剂,分解具有恶臭的噻吩和硫醇。氟化钙用作光学玻璃、光导纤维、搪瓷的原料,用作助熔剂。过氧化钙是缓和的氧化剂,用作杀菌、防腐、漂白药剂,亦用于封闭胶泥的快干剂。
佝偻病患者钙用作高温热还原剂,从氧化物、卤化物制取金属铬、钍、铀、稀土元素、锆,以及磁性材料钐钴合金、吸氢材料镧镍合金和钛镍合金等。Ca–Si合金加入钢中,可以阻止碳化物生成。含钙0.04%的铅钙合金有较高硬度和耐蚀性能,用作电缆线外皮和蓄电池铅板;铝合金中加入钙,可增强塑性。钙还用作冶炼锡青铜、镍、钢的脱氧剂,电子管和电视显像管中的消气剂、有机溶剂的脱水剂、石油精制的脱硫剂、纯制惰性气体(如氦)的除氮剂,分解具有恶臭的噻吩和硫醇。氟化钙用作光学玻璃、光导纤维、搪瓷的原料,用作助熔剂。过氧化钙是缓和的氧化剂,用作杀菌、防腐、漂白药剂,亦用于封闭胶泥的快干剂。
人类:
钙是生物必需的元素。对人体而言,无论肌肉、神经、体液和骨骼中,都有用Ca2+结合的蛋白质。钙是人类骨、齿的主要无机成分,也是神经传递、肌肉收缩、血液凝结、激素释放和乳汁分泌等所必需的元素。钙约占人体质量的1.4%,参与新陈代谢,每天必须补充钙;人体中钙含量不足或过剩都会影响生长发育和健康。
钙是人体中含量最多的无机盐组成元素,健康成人体内钙总量约为1,000~1,300克,约占体重的1.5%~2.0%。其中99%的钙以骨盐形式存在于骨骼和牙齿中,其余分布在软组织中,细胞外液中的钙仅占总钙量的0.1%。骨是钙沉积的主要部位,所以有“钙库”之称。骨钙主要以非晶体的磷酸氢钙(CaHPO4)和晶体的羟磷灰石(3Ca3PO4×Ca(OH)2)两种形式存在,其组成和物化性状随人体生理或病理情况而不断变动。新生骨中磷酸氢钙比陈旧骨多,骨骼成熟过程中逐渐转变成羟磷灰石。骨骼通过不断的成骨和溶骨作用使骨钙与血钙保持动态平衡。
正常情况下,血液中的钙几乎全部存在于血浆中,在各种钙调节激素的作用下血钙相对恒定,为2.25~2.75毫摩/升,儿童稍高,常处于上限。钙在血浆和细胞外液中的存在方式有:(1)蛋白结合钙。约占血钙总量的40%。(2)可扩散结合钙。与有机酸结合的钙,如柠檬酸钙、乳酸钙、磷酸钙等,它们可通过生物膜而扩散,约占13%。(3)血清游离钙。即离子钙(Ca),与上述两种钙不断交换并处于动态平衡之中,其含量与血pH有关。pH下降,[Ca]增大,pH增高,离子钙降低。在正常生理pH范围,离子钙约占47%。在3种血钙中,只有离子钙才起直接的生理作用,激素也是针对离子钙进行调控并受离子钙水平的反馈调节。
细胞内离子钙浓度远低于细胞外离子钙浓度,细胞外离子钙是细胞内离子钙的储存库。钙在细胞内以储存钙、结合钙、游离钙三种形式存在,约80%的钙储存在细胞器(如线粒体、肌浆网、内质网等)内,不同细胞器内的钙并不相互自由扩散,10%~20%的钙分布在胞质中,与可溶性蛋白质及膜表面结合,而游离钙仅占0.1%。
生物钙:
所谓生物钙是采用成熟的淡水珍珠蚌壳作原料,经清洗杂质,用砂轮研磨或NaOH溶液浸泡去除蚌壳外表面的黑皮,将蚌壳干燥、粉碎、吸出的蚌壳细粉中加入3%~5%浓度的酒精烧煮消毒、烘干、再粉碎、过筛使细粉颗粒小于200目,得到白色的天然生物钙粉。用这种方法生产的天然生物钙粉含钙量高达45%左右,并有多种氨基酸,无毒、无激素,可以作为饮料、食品的钙添加剂,容易被人体所吸收。[11]
| 组织 | 湿组织含钙量(mg/kg) |
| 心 | 76.15 |
| 肝 | 64.13 |
| 肾 | 140.30 |
| 脑 | 80.16 |
| 脾 | 84.17 |
| 胎盘 | 248.50 |
| 皮肤 | 172.34 |
| 神经 | 248.50 |
| 平滑肌 | 332.66 |
| 骨骼肌 | 52.10 |
| 软骨 | 260.52~400.80钙与年龄 |
钙的推荐每日供给量标准如下:从初生到10岁儿童600毫克,10~13岁800毫克,13~16岁1200毫克,16~l9岁1000毫克,成年男女800毫克,孕妇1500毫克,乳母2000毫克。青春期前儿童生长发育迅速,钙的需要量也相对最大,可达成人需要量的2~4倍。要特别注意补充。
钙是人体内200多种酶的激活剂,使人体各器官能够正常运作。
钙在人体内是由甲状腺与甲状旁腺进行调节,并且在血钙与骨钙之间维持动态平衡。
钙是人体内含量最多的无机盐:钙是人体内含量最多的一种无机盐。正常人体内钙的含量为1200~1400克,约占人体重量的1.5%~2.0%,其中99%存在于骨骼和牙齿之中。另外,1%的钙大多数呈离子状态存在于软组织、细胞外液和血液中,与骨钙保持着动态平衡。机体内的钙,一方面构成骨骼和牙齿,另一方面则可参与各种生理功能和代谢过程,影响各个器官组织的活动。
钙与镁、钾、钠等离子保持一定比例,使神经、肌肉保持正常的反应;钙可以调节心脏搏动,保持心脏连续交替地收缩和舒张;钙能维持肌肉的收缩和神经冲动的传递;钙能刺激血小板,促使伤口上的血液凝结;在机体中,有许多种酶需要钙的激活,才能显示其活性。
人体是一个有机的生命体,在所有的生命活动过程中,需要有各种物质的参与,这些物质的种类和数量和地球表面的元素组成基本一致。这些元素除碳、氢、氧以有机物的形式存在外,其余的统称矿物质(无机盐)。能测定的人体内的无机盐有20余种。
人体中的钙元素主要以晶体的形式存在于骨骼和牙齿中。人们身体中的矿物质约占体重的5%,钙约占体重的2%。身体的钙大多分布在骨骼和牙齿中,约占总量的99%,其余1%分布在血液、细胞间液及软组织中。
营养价值:钙享有“生命元素”之称,20岁以后的女性尤其需要补充。这是因为,自20岁起,骨质密度即开始缓慢减少,30岁以后减速逐渐加快,从而为骨质疏松症等骨病埋下祸根。此外,缺钙也是导致女性衰老的一大因素,因此补钙对女性来说再重要不过。专家建议,成年妇女每日至少摄取1000毫克钙。若在怀孕期、哺乳期或绝经期,则须加至1500毫克。其最佳来源有乳制品、豆类、绿色蔬菜等。
乳钙是乳清无机盐浓缩物,是营养价值最好的无机盐源且易消化吸收,是直接从牛奶中提取出来的纯天然活性高乳蛋白钙。
乳钙中富含的牛奶矿物质是从牛奶中提取出来的天然来源,这些成分的优势不仅提供平衡的营养组成,还能促进钙的吸收利用,如磷、镁、乳糖和蛋白质等。乳钙中科学的钙磷2:1,最利于人体的吸收利用。
由于牛乳中含有丰富的乳糖和蛋白,故其吸收率大大高于其它普通钙,乳钙吸收率高达62%~70%,是碳酸钙和葡萄糖酸钙的2.5倍,是乳酸钙的1.75倍,是贝类钙的5.5倍。食用乳钙后不会导致气胀、浮肿、便秘,所以乳钙是目前婴儿补钙的最佳来源。
人体成长期需要钙情况:
胎儿期:人的一生都需要补钙。从胎儿第3个月开始,胎儿对钙的需要量骤然增加,母体低钙将直接影响胎儿的身高、体重、头颅、脊椎及四肢的发育。若母体继续缺钙,孕期会造成腿抽筋、流产、难产、骨盆畸形,甚至出现严重的产科并发症,如:妊娠高血压、癫痫、蛋白尿、水肿等,严重危及胎儿和母亲的生命。为避免以上问题,孕期的钙摄入量为每日800~1200毫克。当膳食钙摄入不足时,要及时补充。
新生儿期:新生儿期(出生后28天内):此阶段出现胎儿自生的低钙期,以激发钙的自稳系统的启动,此阶段需要从母乳中摄取大量的钙营养,由于母乳中缺少维生素D,如在出生2周后未及时补充,可能会出现低钙、惊厥、哮喘等危险症状。
婴幼儿期:婴幼儿期(出生~3岁):此阶段为人一生中代谢最旺盛的时期,大脑和身体迅速发育,乳牙长出,此时体内的钙量将直接影响到前期的生长发育。如果缺钙可能出现出牙迟、厌食、多汗、枕秃、鸡胸、O形腿、X形腿,并会发生上呼吸道感染、消化不良、肠炎等,给生活和成长带来不便。
学龄前期至青少年期:学龄前期、学龄期到青少年期(3~18岁以前):此阶段成长速度较快,脑的重量增加,脑的内部结构发育完全,恒牙长出,神经系统发育成熟。到青春期后骨骺逐渐愈合,身高的增长开始变慢并逐渐停止,补钙错过这个阶段,将直接影响到成年后的健康状态。
成人期:成人期(18~45岁):此阶段体内骨钙储存达到最高峰,但这一时期工作、学习、生活的压力加大,会消耗掉体内大量的钙,这一时期如果不补钙,将会引发各种老年性疾病
中老年期:中老年(45岁以后):随着年龄的增长,体内大量的钙营养被消耗,需从骨骼中将钙调入血液,造成骨密度下降,导致骨质疏松症。老年人骨钙丢失可达30%~50%。长期地将骨钙调入血液,可能导致血管、组织、细胞内的钙量增加。随之,血管壁、心肌、肾脏中钙淤积,造成周身麻木、神经衰弱、情感淡漠、便秘、嗜睡、性功能减退、动脉硬化、冠心病、糖尿病、结石症、肿瘤等多种老年性疾病。在此时,甲状腺的C细胞会分泌降钙素促进骨钙还原,在还原过程中又形成了游离钙在大骨节边缘的异位沉积——骨质增生,也就是说,骨质增生是由于缺钙而引起的。这些病理和生理变化致使很多中老年人的生活受到困扰。
植物:植物中紫色苜蓿含钙最高。人体钙:镁:磷的最佳比例为2:1:1,但磷在食物中就能摄取,人们平时的饮食摄入的磷已超过比例。小孩子钙与镁的比例为4:1。
植物从氯化钙等盐类中吸收钙离子。植物类的钙呈离子状态即Ca2+。钙主要存在于叶子的老的器官和组织中,它是一个比较不易移动的元素。钙在生物膜中可作为磷脂的磷酸根和蛋白质的羧基间联系的桥梁,因而可以维持膜结构的稳定性。
胞质溶胶中的钙与可溶性蛋白质即钙调蛋白(又称钙调素,camlmodulin,CaM)结合,形成有活性的Ca.CaM复合体,在代谢调节中起“第二信使”的作用。
钙是构成细胞壁的一种元素,细胞壁的胞间层是由果胶酸钙组成的。缺钙时,细胞壁形成受阻,影响细胞分裂,或者不能形成新细胞壁,出现多核细胞。因此缺钙时生长受抑制,严重时幼嫩器官(根尖、茎端)溃烂坏死。番茄蒂腐病、莴苣顶枯病、芹菜裂茎病、菠菜黑心病、大白菜干心病等都是缺钙引起的。
钙离子和钾离子共同作用调节气孔闭合:气孔关闭时,关闭信号会刺激钙离子进入胞质溶胶,使膜去极化,打开阴离子通道,释放氯离子和苹果酸。依照此原理,阴离子的丧失会进一步去极化,打开钾离子通道,钾离子就被动地伸出到临近的副卫细胞和表皮细胞,气孔就关闭。
风险术语
| 组织 | 湿组织含钙量(mg/kg) |
| 心 | 76.15 |
| 肝 | 64.13 |
| 肾 | 140.30 |
| 脑 | 80.16 |
| 脾 | 84.17 |
| 胎盘 | 248.50 |
| 皮肤 | 172.34 |
| 神经 | 248.50 |
| 平滑肌 | 332.66 |
| 骨骼肌 | 52.10 |
| 软骨 | 260.52~400.80钙与年龄 |
词条图册
日常生活中,如果钙摄入不足,人体就会出现生理性钙透支,造成血钙水平下降。当血钙水平下降到一定阈值时,就会促使甲状旁腺分泌甲状旁腺素。甲状旁腺素具有破骨作用,即将骨骼中的钙反抽调出来,藉以维持血钙水平。在缺钙初期,缺钙程度比较轻的时候,只是发生可逆性生理功能异常,如心脏出现室性早博、情绪不稳定、睡眠质量下降等反应。持续的低血钙,特别是中年以后,人体长期处于负钙平衡状态,导致甲状旁腺分泌亢进,首当其冲的是骨骼,由于骨钙持续大量释出,导致骨质疏松和骨质增生。另一方面,在甲状旁腺持续升高的情况下,由于甲状旁腺素具有促使细胞膜上钙通道开启而关不住,以及阻抑钙泵,使钙泵功能减弱,造成细胞内钙含量升高。持续的细胞内高钙,激发细胞像失控的野马,无节制亢进,造成细胞能量耗竭。与此同时,代谢废物又得不到及时消除,便会构成自身伤害,致使细胞趋向反常的钙化衰亡。由于缺钙,导致骨质疏松、骨质增生、儿童佝偻病、手足抽搐症以及高血压、肾结石、结肠癌、老年痴呆等疾病的发生。
钙可以控制心率和血压,也参与肌肉的收缩活动。没有这种物质,我们的身体就不能自如活动,这也解释了为什么缺钙的人就想整天躺在床上。所以如果由于缺钙感到疲倦,可以吃点意式芝士,酸奶或牛奶。这些都是高钙食品。不过,疲倦仅仅是缺钙的一种表现。失眠、高血压、经前抽筋、怕冷,甚至感到过度紧张也可能是缺钙的标志,因为钙能帮助调节神经系统。
有很多日常可得的食物能帮我们补充钙质、强健骨骼。例如芹菜、油菜、雪里蕻,羊肉和鸡肉,以及各种鱼虾类水产品和大部分干果等。
现代医学研究证明,缺钙会造成人体生理障碍,进而引发一系列严重疾病。这里列举一些与缺钙有关的主要疾病:
高血压:缺钙会造成反常的钙内流,导致钙在血管内壁细胞和平滑肌细胞内反常积贮,引起血管收缩,血管外周阻力增大,血压异常升高。持续的钙内流,促使血管壁弹性纤维和内皮细胞钙化、变性、甚至出现袭痕、断裂。外周阻力进一步增大,血压持续升高。由于血管内壁损伤,脂类通透性增大,血脂浸入血管壁的损伤处,造成胆固醇和其他脂类物质在血管壁上沉积。血管内皮细胞内损伤而分泌内皮素和某些激活因子,引起血小板和白细胞在血管壁上粘附、聚集。血管内皮细胞的损伤,又激活补偿性生理反应,促使血管平滑肌和成纤维细胞反常增生和内膜下移位,致使动脉管壁增厚、变硬,于是层层叠叠、大大小小的动脉粥样硬化形成了。研究表明,对于某些高血压病人来说,不用药物而是增加钙制剂的量,有助于控制高血压。
冠心病:许多研究表明,钙还能降低血中胆固醇的浓度,从而起到保护心脏的作用。有人观察,让胆固醇含量较高的男子食用含钙量低的食物10天(每天410毫克钙),检查他们胆固醇含量;然后再让他们吃含钙量高的食物(每天2200毫克钙)。结果高钙食物能减少胆固醇总量6%,其中低密度脂蛋白减少11%,而对人体有益的高密度脂蛋白数量则保持不变。专家认为,长时期严重缺钙会引发冠心病。
尿路结石:医生告诉肾结石病人限制食用钙,理由是钙为结石的一种主要成分。但是,美国哈佛大学的医学专家经过多年研究后发现,这可能是人类在认识上的一个大错误。他们提出,减少肾结石危险的方法恰恰是增加钙摄入量。大家知道,饮食中,特别是蔬菜中含有大量草酸盐,一般情况下,草酸盐在肠道内与钙结合成草酸钙随粪便排出。如果饮食中钙的摄入不足,就会使多余草酸盐经肠腔吸收而进入血液,最终由肾脏提出。如果人体长期处于负钙平衡状态,肾脏细胞不可避免会出现细胞反常钙内流损伤,肾脏回吸收功能减退,尿钙排出增多。高钙尿液与尿中草酸盐结合,形成大大小小草酸钙结石。如果不忌钙,而是采取补钙措施,尤其是补充水溶性钙剂,那么,在胃肠道中与饮食中草酸盐结合成草酸钙随粪便排出。另外,补充足量的钙可扭转负钙平衡,肾脏回吸收功能正常,尿钙排出减少,结石的可能性也减少。
结(直)肠癌:高脂饮食会过度刺激胆汁的分泌,过量的脂肪酸和胆汁酸是引起结(直)肠细胞癌变的触发剂。有研究证明,患有结肠直肠癌的病人,血清胆汁酸的含量比正常人高出1倍左右,而癌变细胞中胆汁酸含量比正常细胞高3倍以上。如果用高胆汁酸的饲料喂小白鼠,结(直)肠癌的发生率明显增加。如果补充足量的碳酸钙,钙离子与脂肪酸和胆汁酸结合,形成不溶性脂肪酸钙和胆汁酸钙随粪便排出,从而消除癌变的触发因子,就能阻抑肠细胞癌变。
钙与肌肉收缩:人体有着健美的身姿和自如的运动能力,这是因为有骨骼肌的兴奋。骨骼肌的兴奋是由钙起着中心作用的,钙离子在肌肉细胞中的浓度变化,调节骨骼肌肉的收缩与兴奋,即使是人们从人体外表看不见的平滑肌和心肌,也是在钙离子的作用下发生着各种的生理反应。钙像一个指挥官,指挥着全身内外的肌肉运动。在肌肉收缩过程中,当神经纤维接受刺激后,钙离子流入细胞内,此时肌肉中的钙离子浓度是肌肉收缩的基本条件。肌浆网是肌肉中钙的主要储存处,而且是最高度发育的钙运输系统,当骨骼肌受到刺激后,肌浆网中大量的钙将释放出来,细胞外的钙离子进入细胞内,细胞液中的钙离子浓度增加产生肌肉收缩,然后又是在钙泵作用下使肌肉内钙离子排出到细胞外产生肌肉舒张,整个过程迅速而短暂。如果钙在肌肉中的平衡状态遭到破坏,便会引起骨骼肌的疼痛、抽搐以及功能的下降,也会引起体内所有平滑肌和心肌的不正常运动,使人体丧失灵巧和控制自己运动的平衡和协调机能。
手足搐搦症:这种疾病是因婴幼儿体内缺少维生素D而使肠道对钙、磷的吸收发生障碍。另外由于甲状旁腺未能及时分泌更多甲状旁腺素,以致血钙降低,引起神经肌肉的兴奋性增高,出现全身惊厥、手足痉挛和喉痉挛,常伴发阵发性呼吸暂停和短时间窒息,引起缺血缺氧性脑损伤。据医学观察,大脑神经对缺血缺氧最为敏感,窒息10秒钟,神经功能开始出现障碍;窒息数分钟,就会出现血管神经不可逆转的损伤,轻则影响孩子智力,重则导致低能、痴呆。所以,做好手足搐搦症的预防工作是十分重要的,不管是母乳喂养还是人工喂养的孩子,都必须补充足够量的钙。除了补钙外,还要增加户外活动,多晒太阳和补充适量维生素D,以预防手足搐搦症的发生。维生素D是钙离子被骨髓吸收的载体,钙之缘片加入了维生素D,使人体对钙离子吸收能成倍增加。
骨质疏松:人体长期缺钙而引起负钙平衡的另一个严重后果——骨质疏松。很多研究表明,增加钙的摄入量对骨质损耗有着重要减缓作用,在减少由骨质疏松引起的骨折率方面也有着重要作用,特别在食用钙的同时服用维生素D,效果尤其明显。很多专家认为,补钙应在青春期就开始,这时候骨质正在形成,效果会更好。
随着平均期望寿命延长,老年人越来越多,骨质疏松的危害将会越来越突出。
骨质疏松症早期往往没有症状和体征,X线检查又不易发现,所以长期来不被人们注意。即使病情加重,主要表现是骨痛和骨质增生,常常不被医生所认识,往往错诊为腰肌劳损,或是关节炎。随着病情加重,骨量丢失到骨峰值的30%——50%时,骨骼变脆,稍有不慎就可造成骨折。据报告,上海市老年人骨折累计发生率,城市高达16.5%,农村6.9%。这种骨折往往又难愈合,常因久卧不起,并发褥疮或坠积性肺炎,严重者甚至会因此而丧生。



 求购
求购








