- 多元弱酸

多元弱酸
中文名
多元弱酸
所属学科
化学
特点
电离出两个或两个以上的氢离子
定义
分子中含有两个或两个以上的可电离的H+的弱酸都是多元弱酸,多元弱酸是属于弱电解质。
根据酸中所含的可电离氢离子的数目,可以将酸分为一元酸(如HCl、CH3COOH)、二元酸(如H2SO4、H2CO3、H2S)、三元酸(如H3PO4)。其中,HCl为一元强酸,H2SO4虽然可以电离两个氢离子,但是是强酸,不属于多元弱酸,CH3COOH为一元弱酸。[1]
多元弱酸电离
多元弱酸在水中的电离是分步进行的。以磷酸为例介绍
磷酸是三元弱酸,分三步解离。
第一步解离:H3PO4⇌ H[1]
多元弱酸的酸度计算
多元弱酸在溶液中逐级离解,溶液是一个复杂的酸碱平衡体系。以二元弱酸(H2A)为例,设其浓度为c mol/L,解离常数分别为Ka1和Ka2。
1. 质子条件式 [H+] = [HA-] + [A2-] + [OH-] ,将有关平衡常数代入,并整理后得到计算[H+] 的精确式:
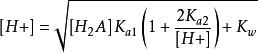
2. 计算[H+]的近似式和最简式
(1) 当cKa1≥ 20 Kw时,上式中的Kw项可忽略。
(2) 当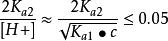 ,可将其略去,即第二步解离也可忽略,得
,可将其略去,即第二步解离也可忽略,得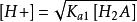 。而[H2A] ≈ c - [H+],代入整理得到二元弱酸中H+浓度的近似式:
。而[H2A] ≈ c - [H+],代入整理得到二元弱酸中H+浓度的近似式:
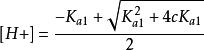
实际上是忽略了二级解离,将二元弱酸按照一元弱酸处理。一般多元弱酸,只要浓度不太小,各步解离常数差别不太小,均可按一元弱酸处理。
(3)当c/Ka1≥ 500时,而[H2A] ≈ c - [H+] ≈ c,得计算二元弱酸溶液中[H+]浓度的最简式: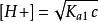 。[2]
。[2]

相关百科
-
长城炮引领多元生活方式 试驾长城炮越野皮卡
2025-09-17 01:03:54 查看详情 -
长城炮引领多元生活方式 评测长城哈弗H9中大型SUV怎么样
2025-09-17 01:03:54 查看详情 -
长城炮乘用皮卡全球版 长城炮引领多元生活方式
2025-09-17 01:03:54 查看详情 -
长城造 长城炮引领多元生活方式
2025-09-17 01:03:54 查看详情 -
长城炮引领多元生活方式 成都长城哈弗H6现车充足
2025-09-17 01:03:54 查看详情 -
长城炮给出答案 长城炮引领多元生活方式
2025-09-17 01:03:54 查看详情 -
长城炮引领多元生活方式 越野利器火炮来袭
2025-09-17 01:03:54 查看详情 -
长城炮引领多元生活方式 长城汽车在海外掀起年轻风暴
2025-09-17 01:03:54 查看详情 -
长城炮引领多元生活方式 驾驭长城炮
2025-09-17 01:03:54 查看详情 -
长城炮引领多元生活方式 价格优惠
2025-09-17 01:03:54 查看详情


 求购
求购

