- 穿孔素

穿孔素
定义
中文名称:穿孔素
英文名称:perforin;Pf
应用学科:免疫学(一级学科);免疫系统(二级学科);免疫分子(三级学科)
具有细胞毒作用的效应分子。贮存在细胞毒性T细胞和NK细胞胞质颗粒中,两类效应细胞与靶细胞接触而激发颗粒胞吐,所释放的穿孔素通过聚合作用而在靶细胞表面形成小孔,从而介导杀伤作用。
简介
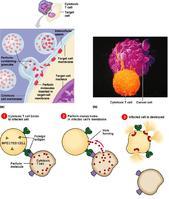 穿孔素(perforin,又称成 孔蛋白pore-forming protein, PFP)是一种分子量为67kD,存在于
细胞毒性T淋巴细胞(CTL)和 NK细胞胞质的细胞毒颗粒中的
糖蛋白,又称C9相关蛋白或 溶细胞素(cytolysin),成熟的穿孔素分子由534个
氨基酸残基组成,分子量为56-75kDa,IP为6.4,穿孔素分子中央部位170-390之间的氨基酸序列与C9328-560氨酸酸序列约有20%
同源性。当与 靶细胞密切接触相互作用后,细胞可释放穿孔素。穿孔素的作用是在靶细胞膜上形成多聚穿孔素管状通道,导致靶细胞溶解破坏。在Ca2+存在下,插入靶细胞膜上,并多聚化形成管状的多聚穿孔素(polyperforin),约含12-16个穿孔素分子,分子量可达1000kDa。多聚穿孔素在靶细胞膜上形成穿膜的管状结构,内径平均16nm。这种异常的通道使Na+、水分进入靶细胞内,K+及
大分子物质(如蛋白质)从靶细胞内流出,改变 细胞渗透压,最终导致细胞溶解。此过程与补体介导的溶细胞过程类似,溶解细胞过程比较迅速。CTL本身可能释放A型硫酸
软骨素
蛋白聚糖(proteoglycans of chondroitinsulphate A type)、 硫酸软骨素A 限制因子(homologous restriction factor,HRF),因此可避免穿孔素对CTL自身细胞的攻击
穿孔素(perforin,又称成 孔蛋白pore-forming protein, PFP)是一种分子量为67kD,存在于
细胞毒性T淋巴细胞(CTL)和 NK细胞胞质的细胞毒颗粒中的
糖蛋白,又称C9相关蛋白或 溶细胞素(cytolysin),成熟的穿孔素分子由534个
氨基酸残基组成,分子量为56-75kDa,IP为6.4,穿孔素分子中央部位170-390之间的氨基酸序列与C9328-560氨酸酸序列约有20%
同源性。当与 靶细胞密切接触相互作用后,细胞可释放穿孔素。穿孔素的作用是在靶细胞膜上形成多聚穿孔素管状通道,导致靶细胞溶解破坏。在Ca2+存在下,插入靶细胞膜上,并多聚化形成管状的多聚穿孔素(polyperforin),约含12-16个穿孔素分子,分子量可达1000kDa。多聚穿孔素在靶细胞膜上形成穿膜的管状结构,内径平均16nm。这种异常的通道使Na+、水分进入靶细胞内,K+及
大分子物质(如蛋白质)从靶细胞内流出,改变 细胞渗透压,最终导致细胞溶解。此过程与补体介导的溶细胞过程类似,溶解细胞过程比较迅速。CTL本身可能释放A型硫酸
软骨素
蛋白聚糖(proteoglycans of chondroitinsulphate A type)、 硫酸软骨素A 限制因子(homologous restriction factor,HRF),因此可避免穿孔素对CTL自身细胞的攻击
特点
1、穿孔素储存于CTL细胞和NK细胞的胞浆颗粒中,是这些细胞杀伤靶细胞的主要效应分子。
2、CTL和NK细胞被激活后胞浆颗粒释放出来,穿孔素单体可迅速插入靶细胞的胞浆膜,多个单体聚合形成打孔聚合物,在靶细胞膜上形成不同孔径的跨膜通道,从而导致靶细胞膜去极化,使细胞外水分进入细胞内,一些电解质和大分子物质流出细胞外,最终引起靶细胞渗透性死亡。
3、对靶细胞进行攻击后的CTL和NK细胞与裂解细胞分离,又可攻击其他靶细胞。
4、穿孔素形成的孔还可以使颗粒酶进入靶细胞,引起靶细胞凋亡。
5、穿孔素还可使一些颗粒分子如颗粒溶解素(granulysin)进入靶细胞内,对胞内感染发挥免疫作用。
主要作用
在乙型病毒性肝炎中的作用
乙肝病毒无直接致细胞病变作用,肝细胞的损伤是乙肝病毒与机体的免疫系统相互作用的结果。在急性乙肝病毒感染期间,机体通常形成强烈的多克隆、多特异性的T细胞应答,反应可以针对乙肝病毒蛋白的多个表位,因此,病毒通常被清除,感染呈自限性的过程。在慢性乙肝病毒感染期间,特异性CD4+和CD8+T细胞的功能均低下,因此病毒难以被清除。CTLs的细胞毒效应是清除肝细胞内乙肝病毒的主要机制。通常,CTLs依赖两条独立的途径发挥其细胞毒作用,即穿孔素途径和凋亡途径。
在鼠肝炎模型中穿孔素的研究
在乙肝病毒转基因鼠的研究中,发现Fas配体(FasL)和穿孔素可以诱导肝脏的损害,但是体内的CTLs必须要同时激活这两条信号途径才能引起对靶细胞的杀伤。给HBV转基因小鼠过继MHC-Ⅰ类抗原限制的HBsAg特异性CTLs,可以诱发典型的急性肝炎。
其免疫病理过程为:首先,HBsAg特异性CTLs进入肝内黏附于HBsAg阳性细胞,通过FasL/Fas和穿孔素途径导致大部分肝细胞的凋亡和坏死;其次,中性粒细胞等炎性细胞聚集并杀伤肝细胞;再次,在TNF-α和IFN-γ等细胞因子的参与下,大量淋巴细胞、单核细胞浸润和Kupffer细胞活化,使HBsAg阳性肝细胞大量死亡。比较研究显示,急性土拨鼠肝炎的PBMCs更具细胞毒性,这种毒性的增加完全是由穿孔素介导的。
在乙肝患者中穿孔素的研究
 较早的研究发现,在慢性乙肝患者肝组织中,肝内T淋巴细胞和Kupffer细胞表达穿孔素和颗粒酶B,而正常人肝组织中缺乏这两种蛋白的表达[8]。Tagashira等[9]在15例慢性乙肝患者肝组织活检标本中均检测到穿孔素mRNA,而在脂肪肝、Gilbert综合征和Dubin-Johnson综合征等患者的肝组织中则不能检测到。
较早的研究发现,在慢性乙肝患者肝组织中,肝内T淋巴细胞和Kupffer细胞表达穿孔素和颗粒酶B,而正常人肝组织中缺乏这两种蛋白的表达[8]。Tagashira等[9]在15例慢性乙肝患者肝组织活检标本中均检测到穿孔素mRNA,而在脂肪肝、Gilbert综合征和Dubin-Johnson综合征等患者的肝组织中则不能检测到。
半定量分析显示,慢性乙肝患者肝组织穿孔素mRNA的强度与组织活动性指数及血清ALT水平呈正相关关系。
在丙型病毒性肝炎中的作用
急性丙型肝炎通常没有临床症状,但容易变成慢性肝炎。慢性丙型肝炎的组织学特征是单个核细胞的浸润和肝细胞的坏死和纤维化,但HCV感染的发病机制仍不十分明了。一方面,HCV可能对肝细胞有细胞病变效应,肝细胞的脂肪变可能是HCV直接导致的,特别是HCV基因3型;另一方面,HCV又被认为是非致细胞病变病毒,HCV感染的患者CTLs在病毒的清除和肝细胞的损伤中发挥了重要的作用。
在丙肝急性期,研究发现HCV特异性CD8+T细胞增生低下,表达穿孔素水平较低,溶细胞活性下降和产生干扰素-γ减少。但在急性自限性的丙肝患者中,这种缺陷是短暂的,HCV特异性CD8+T细胞的功能会因病情的改善而得到恢复。
其他研究
蛋白扮演清道夫角色
2010年10月31日,据美国物理学家组织网报道,澳大利亚和英国的一个联合研究小组发现,一种被称为穿孔素的蛋白质可在细胞膜上打孔,从而杀死体内的无赖细胞。他们发现的这种“刺杀”机制有助于研发提高免疫力或是根据需要抑制免疫力的新方法。
该研究项目负责人、澳大利亚莫纳什大学的詹姆斯・威什托克称,穿孔素是人体中的死亡武器和清道夫。它们能强行闯进被病毒劫持了的细胞或癌细胞中,从而使有毒的酶进来,从内部破坏细胞。没有它们,我们的免疫系统就无法杀死受感染细胞和癌变细胞。
实验过程
澳大利亚莫纳什大学、墨尔本彼得・麦卡勒姆癌症中心和英国伦敦大学伯克贝克学院的研究人员进行了为期10年的合作,共同分析穿孔素的蛋白质职能,也就是它的结构和功能。
他们利用在澳大利亚的同步加速器,揭示了蛋白质的结构。然后通过伯克贝克学院强大的电子显微镜,根据单个穿孔素分子的精细结构,构建了穿孔素蛋白在样本膜上形成孔洞的系列模型,揭示了这种蛋白质是如何装配组合并在细胞膜上打出孔洞的。
新研究也证实穿孔素蛋白分子跟一些细菌分泌的毒素非常相似,比如炭疽病菌、李斯特菌和链球菌。但是,当正常细胞被误认为是应该清除的细胞时,穿孔素也会犯错误,这种情况就会导致自体免疫疾病,比如组织对骨髓移植的排斥。
应用机制
目前(2010年)他们已经掌握了穿孔素蛋白发挥作用的机制,这将为治疗癌症、疟疾和糖尿病带来福音。 此外,研究人员也正在寻求一种方法,加强穿孔素在癌症防御方面的能力,用于治疗急性病。同时,他们也在研究一种抑制剂,抑制穿孔素以克服机体组织的排异反应。
最新进展
110年前诺贝尔奖获得者JulesBordet第一次发现了人体免疫细胞能够在靶细胞表面形成小孔,然而长期以来科学家们对其具体机制却不清楚。
“穿孔素是我们身体内杀伤清除异常细胞的重要武器,”研究的负责人、澳大利亚莫纳什大学(MonashUniversity)的JamesWhisstock教授说道:“当细胞受到病毒侵袭或转化为癌细胞时,效应细胞与靶细胞接触,通过穿孔素在靶细胞膜上形成活性孔道,并向靶细胞内释放颗粒酶,诱导靶细胞裂解死亡。没有穿孔素我们的免疫系统将无法破坏异常的细胞。现在我们知道了穿孔素的作用机制,通过它我们能够更好地治疗癌症、疟疾和糖尿病。”
来自莫纳什大学、澳大利亚墨尔本皮特?马克卡伦癌症中心(PeterMacCallumCancerCentre)及伦敦大学伯克贝克学院(BirkbeckCollege)的研究人员共同合作历时十年揭示了穿孔素的分子结构和功能。新研究证实穿孔素分子中有一些重要的成分与某些细菌例如炭疽、李斯特菌属和链球菌属的毒素非常相似。“我们猜想这种分子结构已存在了接近20亿年,”皮特?马克卡伦癌症中心癌症免疫学计划的负责人JoeTrapani教授说。
借助澳大利亚的同步加速器以及伯克贝克学院的电子显微镜,研究人员揭示了穿孔素的分子结构。通过电子显微镜技术在人工细胞膜上重建穿孔素形成的小孔并结合穿孔素分子结构分析,研究人员发现了穿孔素在靶细胞膜上聚集形成跨膜通道的机制。
“在这项研究工作中同步加速器发挥了重要的作用,”Whisstock说:“没有这个高效力的设备我们根本无法开展这项研究。”Trapani说:“穿孔素是机体免疫系统杀伤异常细胞的一个有力的武器。当穿孔素分子不能正常发挥功能时,机体将无法对抗感染细胞。来自小鼠的研究证实当机体发生穿孔素缺陷时,会导致特异性的恶性肿瘤——白血病。此外穿孔素还是在自身免疫疾病例如早发性糖尿病或骨髓移植组织排斥反应中错误识别清除细胞的罪魁祸首。”
目前研究人员正在致力寻找新的方法以推动穿孔素研究用于对癌症以及一些急性病如脑型疟的治疗。此外他们还获得了来自维康信托基金100万美元的资金资助用于开发有潜力的穿孔素抑制剂抑制组织免疫排斥反应。

-
BMW 上海车展:迸发的肾上腺素
2025-11-01 08:52:33 查看详情 -
BMW原厂制动盘/片全面优惠进行中 上海车展:迸发的肾上腺素
2025-11-01 08:52:33 查看详情


 求购
求购









