- 羰基

羰基
羰基简介
 羰基有机化学中,羰基化合物指的是一类含有羰基的化合物。
羰基有机化学中,羰基化合物指的是一类含有羰基的化合物。
由一个 sp2或sp杂化(见杂化轨道)的碳原子与一个氧原子通过双键(见化学键)相结合而成的基团,可以表示为:羰基C=O的双键的键长约1.22埃。
由于氧的电负性(3.5)大于碳的电负性(2.5),C=O键的电子云分布偏向于氧原子:这个特点决定了羰基的极性和化学反应性。
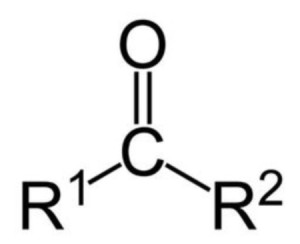
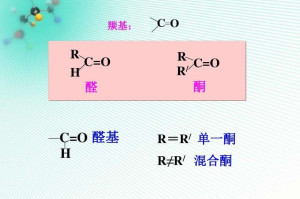
构成羰基的碳原子的另外两个键,可以单键或双键的形式与其他原子或基团相结合而成为种类繁多的羰基化合物。羰基化合物可分为醛酮类和羧酸类两类(R为烷基):
醛酮类:R─CH=O 醛
R─CO─R 酮
羧酸类:R─CO─OH 羧酸
R─CO─OR′羧酸酯
R─CO─O─CO─R′酸酐
R─CO─O─O─CO─R′酰基过氧化物
R─CO─NH2酰胺
R─CO─X(X─F、Cl、Br、I)酰卤
R─CH=C=O烯酮
R─N=C=O异氰酸酯
由于碳原子和氧原子的电负性差别,羰基化合物容易与亲核试剂发生亲核加成反应。
羰基的性质很活泼,容易起加成反应,如与氢生成醇。
簇合物中的键结模式
在羰基簇合物化学中,羰基配体有许多不同的键结模式 。大部份常见的羰基配体都是端接配体,但羰基也常连接2个或3个金属原子,形成μ2或μ3的桥接配体)。有时羰基中的碳和氧原子都会参与键结,例如μ3-η就是一个哈普托数为2,连接3个金属原子的桥接配体。
金属中心原子形成反馈π键使M-C键能增强,同时活化了-C-O键。
羰基性质
 羰基物理性质:具有强红外吸收。
羰基物理性质:具有强红外吸收。
化学性质:由于氧的强吸电子性,碳原子上易发生亲核加成反应。其它常见化学反应包括:亲核还原反应,羟醛缩合反应。
羰基特征
在进行金属羰基配合物的分析时,常会使用红外吸收光谱法。在一氧化碳气体,C-O键的振动(一般以νCO表示)出现在光谱中2143cm-1的位置。νCO的位置和金属和碳之间键结强度呈现负相关的关系。
| 物质 | 位置 |
|---|---|
| CO | 2143 |
| Ti(CO)6 | 1748 |
| V(CO)6 | 1859 |
| Cr(CO)6 | 2000 |
| Mn(CO)6 | 2100 |
| Fe(CO)6 | 2204 |
| Fe(CO)5 | 2022, 2000 |
除了振动的频率外,频谱中νCO的个数也可用来分析配合物的结构,八面体结构旳配合物(如 Cr(CO)6),其频谱只有一个νCO。对称性较弱的配合物, 其频谱也会比较复杂。
如Fe2(CO)9的光谱中,CO键的振动频率就出现在2082, 2019, 1829cm-1。
在簇合物中也可以用νCO看出CO配基的配位方式。
桥接(μ2)的羰基配体其νCO会比一般端接的羰基配体低100-200cm-1。μ3的羰基配体其νCO会更低。以下是典型铑簇合物的νCO:[3]
| 羰基配体 | 位置 | 位置 | 位置 |
|---|---|---|---|
| Rh2(CO)8 | 2060, 2084 | 1846, 1862 | |
| Rh4(CO)12 | 2044, 2070, 2074 | 1886 | |
| Rh6(CO)16 | 2045, 2075 | 1819 |
化合之物
| 物质 | 位置 |
|---|---|
| CO | 2143 |
| Ti(CO)6 | 1748 |
| V(CO)6 | 1859 |
| Cr(CO)6 | 2000 |
| Mn(CO)6 | 2100 |
| Fe(CO)6 | 2204 |
| Fe(CO)5 | 2022, 2000 |
结构和命名
| 羰基配体 | 位置 | 位置 | 位置 |
|---|---|---|---|
| Rh2(CO)8 | 2060, 2084 | 1846, 1862 | |
| Rh4(CO)12 | 2044, 2070, 2074 | 1886 | |
| Rh6(CO)16 | 2045, 2075 | 1819 |
物理性质
化学性质
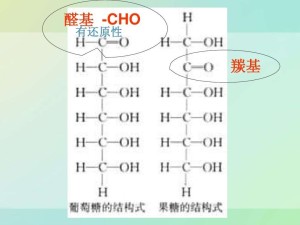 羰基羰基化合物的结构:
羰基羰基化合物的结构:
在醛(Aldehydes)和酮(Ketones)分子中,都含有一个共同的官能团-羰基,故统称为羰基化合物。醛分子中,羰基至少要与一个氢原子直接相连,故醛基一定位于链端。
羰基化合物的命名:
(1)普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
可用α、β、γ、δ等标记取代基位置。
(2)系统命名法
当分子中含有多种官能团时,首先要确定一个主官能团,然后,选含有主官能团及尽可能含较多官能团的最长碳链为主链。主链编号的原则是要让主官能团的位次尽可能小。命名时,根据主官能团确定母体的名称,其它官能团作为取代基用词头表示,分子中如涉及立体结构要在名称最前面表明其构型,然后根据名称的基本格式写出名称。
词条图册
 羰基(1)沸点:羰基具有偶极矩,增加了分子间的吸引力,沸点比相应相对分子质量的烷烃高,但比醇低。
羰基(1)沸点:羰基具有偶极矩,增加了分子间的吸引力,沸点比相应相对分子质量的烷烃高,但比醇低。
(2)水溶性:醛酮的氧原子可以与水形成氢键,因此低级醛酮能与水混溶。



 求购
求购







