- 基因编辑

基因编辑
技术简介
 基因编辑(3)基因编辑(gene editing),又称基因组编辑(genome edting)或基因组工程(genome engineering),是一种新兴的比较精确的能对生物体基因组特定目标基因进行修饰的一种基因工程技术或过程。
基因编辑(3)基因编辑(gene editing),又称基因组编辑(genome edting)或基因组工程(genome engineering),是一种新兴的比较精确的能对生物体基因组特定目标基因进行修饰的一种基因工程技术或过程。
早期的基因工程技术只能将将外源或内源遗传物质随机插入宿主基因组,基因编辑则能定点编辑想要编辑的基因。
基因编辑依赖于经过基因工程改造的核酸酶,也称“分子剪刀”,在基因组中特定位置产生位点特异性双链断裂(DSB),诱导生物体通过非同源末端连接(NHEJ)或同源重组(HR)来修复DSB,因为这个修复过程容易出错,从而导致靶向突变。这种靶向突变就是基因编辑。
基因编辑以其能够高效率地进行定点基因组编辑, 在基因研究、基因治疗和遗传改良等方面展示出了巨大的潜力。
技术背景
自DNA双螺旋结构被揭秘以来,科学家已经开始探讨如何操作和编辑DNA,特别是如何在基因组上特定位点进行有目的的改造。20世纪70年代,随着在酵母和细菌中发现DNA修复和同源重组机制,基于DNA同源重组技术的基因打靶策略孕育而生,使得靶向的基因修饰成为了可能。
 基因编辑1981年,第一株小鼠胚胎干细胞系建立,科学家获得了靶向基因编辑动物模型成功。1997年,体细胞克隆羊多莉(Dolly)问世,使产出靶向基因编辑的动物模型成为可能。之后,多种高效的DNA靶向内切酶被发现,主要包括锌指核酸酶(zinc finger nucleases, ZFN)、类转录激活样效应因子核酸酶(transcription activator-like effector nucleases, TALEN)、规律成簇间隔短回文重复序列(cluster regularly interspaced short palindromic repeats, CRISPR-Cas)应用最为广泛,又以CRISPR-Cas技术最为简便、快捷,自2012年问世以来,已经迅速在生命科学研究的各个领域发挥了重要作用。[3]
基因编辑1981年,第一株小鼠胚胎干细胞系建立,科学家获得了靶向基因编辑动物模型成功。1997年,体细胞克隆羊多莉(Dolly)问世,使产出靶向基因编辑的动物模型成为可能。之后,多种高效的DNA靶向内切酶被发现,主要包括锌指核酸酶(zinc finger nucleases, ZFN)、类转录激活样效应因子核酸酶(transcription activator-like effector nucleases, TALEN)、规律成簇间隔短回文重复序列(cluster regularly interspaced short palindromic repeats, CRISPR-Cas)应用最为广泛,又以CRISPR-Cas技术最为简便、快捷,自2012年问世以来,已经迅速在生命科学研究的各个领域发挥了重要作用。[3]
技术原理
ZFNs、TALENs和CRISPR/Cas9系统(通常简称CRISPR)皆是通过在特定的靶向序列处引入双链断裂的缺口,继而通过细胞内两种DNA修复机制完成修复。在CRISPR发明之前,已经有ZFN技术可以用来做类似精准的基因编辑,但使用起来极其繁琐、昂贵。随后,TALEN技术的发明改变了这一点,使基因编辑变得简单和便利一些。但是,技术的快速发展与迭代使得CRISPR已成为生物学中自重组DNA诞生以来最具突破性的工具之一。
ZFN的特异性取决于锌指蛋白(ZFP),获得高效特异性的ZFN前提是筛选高质量的ZFP,主要方法包括Sangamo Biosciences提供的专利技术和锌指协会开发的资源免费共享平台(OPEN),ZFP一旦于基因特定序列结合,Fok I核酸内切酶会在DNA双链上形成二聚体发挥内切酶活性,产生双链切口,继而通过细胞内修复机制对断裂部位的基因进行修饰。
TALEN包括两个重复可变的双氨基酸残基(RVDs)位点,TALEN特异性识别DNA原理在于RVD可以与DNA碱基结合,进而切开DNA双链。
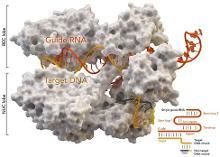 CRISPE/Cas9系统(5)最初是根据细菌或古细菌对外源入侵分子系统改造而成,可通过蛋白质和RNA的复合物对基因组特定序列进行切割。CRISPE/Cas9基因编辑技术的影响深远,从改变老鼠皮毛的颜色到设计不传播疟疾的蚊子和抗虫害作物,再到修正镰状细胞性贫血等各类遗传疾病等等。自2012年以来,研究人员常用CRISPR基因编辑技术对生物的DNA序列进行修剪、切断、替换或添加。CRISPR来自微生物的免疫系统,这种工程编辑系统利用一种酶,能把一段作为引导工具的小RNA切入DNA,就能在此处切断或做其他改变。以往研究表明,通过这些介入,CRISPR能使基因组更有效地产生变化或突变,效率比TALEN(转录激活因子类感受器核酸酶)等其他基因编辑技术更高。虽然CRISPR有许多优点,在人类癌细胞系列中,它也可能产生大量“误伤目标”,尤其是对不希望改变的基因做修改。
CRISPE/Cas9系统(5)最初是根据细菌或古细菌对外源入侵分子系统改造而成,可通过蛋白质和RNA的复合物对基因组特定序列进行切割。CRISPE/Cas9基因编辑技术的影响深远,从改变老鼠皮毛的颜色到设计不传播疟疾的蚊子和抗虫害作物,再到修正镰状细胞性贫血等各类遗传疾病等等。自2012年以来,研究人员常用CRISPR基因编辑技术对生物的DNA序列进行修剪、切断、替换或添加。CRISPR来自微生物的免疫系统,这种工程编辑系统利用一种酶,能把一段作为引导工具的小RNA切入DNA,就能在此处切断或做其他改变。以往研究表明,通过这些介入,CRISPR能使基因组更有效地产生变化或突变,效率比TALEN(转录激活因子类感受器核酸酶)等其他基因编辑技术更高。虽然CRISPR有许多优点,在人类癌细胞系列中,它也可能产生大量“误伤目标”,尤其是对不希望改变的基因做修改。
CRISPR/Cas系统可分为两大类:第1类CRISPR/Cas系统和第2类CRISPR/Cas系统。
2018年12月6日,来自美国Arbor生物技术公司在学术期刊Science发布论文,揭示了V型CRISPR-Cas的不同进化途径中出现多能多样性,从而扩展CRISPR工具箱。研究人员鉴定出Cas12蛋白的其他成员:Cas12c、Cas12g、Cas12h和Cas12i展现出RNA引导的双链DNA(dsDNA)干扰活性。Cas12i对crRNA间隔序列的互补链和非互补链表现出显著不同的切割效率,从而主要导致dsDNA切口。作为一种核糖核酸酶(RNase),Cas12g表现出RNA指导的靶向切割RNA活性,此外还附带具有非特异性地反式切割单链DNA(ssDNA)的活性。[4]
执行手段
 基因编辑(4)1)基因敲除:如果想使某个基因的功能丧失,可以在这个基因上产生DSB,非同源末端连接(NHEJ)修复的过程中往往会产生DNA的插入或删除(indel),造成移码突变,从而实现基因敲除。
基因编辑(4)1)基因敲除:如果想使某个基因的功能丧失,可以在这个基因上产生DSB,非同源末端连接(NHEJ)修复的过程中往往会产生DNA的插入或删除(indel),造成移码突变,从而实现基因敲除。
2)特异突变引入:如果想把某个特异的突变引入到基因组上,需要通过同源重组来实现,这时候要提供一个含有特异突变同源模版。正常情况下同源重组效率非常低,而在这个位点产生DSB会极大的提高重组效率,从而实现特异突变的引入。
3)定点转基因:与特异突变引入的原理一样,在同源模版中间加入一个转基因,这个转基因在DSB修复过程中会被拷贝到基因组中,从而实现定点转基因。通过定点转基因的方法可以把基因插入到人的基因组AAVS1位点,这个位点是一个开放位点,支持转基因长期稳定的表达,破坏这个位点对细胞没有不良影响,因此被广泛利用。
技术应用
 基因编辑(3)有着“豪华版”诺奖之称的“2015年度生命科学突破奖”颁发给了发现基因组编辑工具“CRISPR/Cas9”的两位美女科学家——珍妮弗·杜德娜和艾曼纽·夏邦杰。二人更是获得了2015年度化学领域的引文桂冠奖——素有诺奖“风向标”之称,曾被认为是2015年诺贝尔化学奖的最有力竞争者。
基因编辑(3)有着“豪华版”诺奖之称的“2015年度生命科学突破奖”颁发给了发现基因组编辑工具“CRISPR/Cas9”的两位美女科学家——珍妮弗·杜德娜和艾曼纽·夏邦杰。二人更是获得了2015年度化学领域的引文桂冠奖——素有诺奖“风向标”之称,曾被认为是2015年诺贝尔化学奖的最有力竞争者。
2018年11月,中国深圳的科学家贺建奎宣布,他们团队创造的一对名为露露和娜娜的基因编辑婴儿在中国诞生。这对双胞胎的一个基因经过修改,使她们出生后就能天然抵抗艾滋病,这是世界首例免疫艾滋病的基因编辑婴儿。
2018年12月,美国一家基因编辑公司宣布,将启动一项利用CRISPR基因编辑技术治疗某种遗传性眼疾的临床试验,相关申请已被美国监管部门接受。在这一临床试验中,基因编辑的对象是先天性黑朦病患者眼睛里的感光细胞,这是一种体细胞,而非生殖细胞。体细胞的遗传信息不会遗传给下一代,所以不涉及伦理道德问题。[5]
发展历程
 基因编辑(3)基因编辑创造首例非人类灵长目动物
基因编辑(3)基因编辑创造首例非人类灵长目动物
2014年,南京大学的研究人员宣布成功创造出定向突变的基因工程猴,这是有记录以来首次在非人类灵长目动物身上成功使用此项技术。
首例对人体使用基因编辑技术CRISPR的试验
2016年8月,四川大学华西医院肿瘤学家卢铀率领的一个中国科学家团队将开展全球首例对人体使用革命性基因编辑技术CRISPR的试验。该团队计划于2016年8月开始在肺癌患者身上测试经过CRISPR技术编辑的细胞。这些研究人员计划招募一批转移性非小细胞肺癌患者,对他们来说,化疗和放疗等其他选择都已失败。他们将从患者血液中提取免疫细胞,利用CRISPR加入一个帮助免疫系统定向清除肿瘤的新基因序列,然后再把这些细胞注入患者的血液。美国已经批准一个由技术大亨肖恩·帕克支持的研究团队开展CRISPR人类测试。需要指出的是,四川大学开展的试验不编辑基因种系,其影响不会被遗传。
CRISPR技术用于人类iPSCs
2015年1月6日,为了研究这种副作用在人类其他细胞中是否也存在,研究小组用CRISPR和TALEN两种系统在人类的iPSCs中进行实验,让它们在iPSCs中切下已知的基因片段,或切掉后再换上其他的。他们用JAK2、SERPINA1和AAVS1基因作为模型,JAK2基因变异会导致骨髓紊乱,真性红细胞增多症;SERPINA1基因变异会导致alpha1-抗胰蛋白酶缺乏,这是一种遗传性紊乱,会造成肺和肝脏疾病;而AAVS1最近发现是人类基因组中的“安全港”,可以插入外来基因。通过比较发现,在这三个基因系统中,如果只是简单地切掉部分基因,CRISPR系统明显比TALEN更有效,产生的剪切是后者的100倍;而在做基因替代操作时,如替代JAK2和SERPINA1中的致病变异,CRISPR和TALEN的效率相当。
研究人员还指出,与人类癌细胞系研究不同的是,无论CRISPR还是TALEN,在人类iPSCs中同样都有着目标特异性,即只瞄准那些为它们设定的目标基因。他们还发现,CRISPR系统比TALEN更有优势:CRISPR可以设计成只瞄准病人体内含有变异的基因,而不影响健康基因,即只影响某个基因的一个副本。这些成果与以往的干细胞研究成果结合,使CRISPR成为一种有用的人类iPSCs基因剪辑工具,其偏离目标的风险更小。
约翰·霍普金斯大学医学院导师叶朝辉(音译)说,他们的研究详细说明了如何将CRISPR技术用于人类iPSCs,展现了该技术在这类细胞中的潜力。“干细胞技术正在迅速发展。我们认为,将iPSCs用于人类治疗的日子已经不远。”[6]
美国约翰·霍普金斯大学医学院的科学家证明,CRISPE/Cas9系统还能精确有效地改变人类的干细胞,这一发现简化了对诱导多能干细胞(iPSCs)的修改和定制,有望更快在治疗上取得成果,开发出用于疾病研究和药物测试的模型系统。相关论文在线发表在《分子治疗》上。
靶向RNA的基因编辑工具诞生
2018年3月,Silvana Konermann等人构建出一种靶向RNA而不是靶向DNA的新工具,并利用它校正来自一名痴呆症患者的细胞中的蛋白不平衡,从而让它们恢复到健康水平。这种被称作CasRx的新工具来自黄化瘤胃球菌(Ruminococcus flavefaciens)XPD3002,它为科学家们提供一种强大的方法来开发新的基因疗法和研究基础的生物学功能。[7]
光触发的基因编辑技术面世
2018年7月,Demosthenes P. Morales等人开发出光触发的基因组编辑方法,这种方法的关键是空心的金纳米球,在这些金纳米球上包被着DNA报告链(发出红色荧光)和由Cre重组酶与细胞穿透肽组成的融合蛋白。一旦被摄入到细胞中,这些金纳米球被包埋在内体(endosome)中。超快脉冲近红外激光 ---对细胞无害且高效地穿过组织---随后照射这些被包埋的金纳米球和它们的蛋白涂层。这种照射导致这些金纳米球受到激发,这会导致纳米气泡形成,从而让内体出现开口并允许它的蛋白内含物逃出。这些蛋白如今自由地前往存储着遗传物质的细胞核中,并让细胞穿透肽进入。Cre能够寻找、剪切细胞中的双螺旋DNA,并且将DNA报告链粘贴到双螺旋DNA中。[7]
首例特定长寿基因敲除的食蟹猴模型
2018年8月,我国科学家Weiqi Zhang等人在全球首次实现了SIRT6在非人灵长类动物中的全身敲除,获得了世界上首例特定长寿基因敲除的食蟹猴模型。与SIRT6敲除小鼠表现的加速衰老表型明显不同,SIRT6敲除的食蟹猴在出生数小时内即死亡。多项分析结果显示,SIRT6敲除的食蟹猴未见加速衰老表型,却表现出严重的全身发育迟缓。新生SIRT6敲除猴的脑及多种其他器官组织均表现出明显的胚胎期未成熟的细胞和分子特征。在此之前,我国科学家Sen Yan等人利用CRISPR/Cas9基因编辑技术将人体中导致亨廷顿舞蹈病(Huntington's disease, HD)的具有非常长的谷氨酰胺重复序列的mHTT编码基因的一个片段导入到猪成纤维细胞中。随后,体细胞核移植产生携带这种基因改变的猪胚胎,由此构建出基因敲入HD猪模型。[7]
成功研发存储转录事件的细胞记录设备
2018年10月,Florian Schmidt等人利用肠道细菌大肠杆菌开展研究,将来自一种不同的细菌物种的编码CRISPR-Cas9系统的基因导入到大肠杆菌中,其中的Cas9基因与一种逆转录酶融合在一起。导入这些编码CRISPR-Cas9的外源基因的大肠杆菌细胞能够产生一种结合短mRNA分子的蛋白复合物。这种逆转录酶将mRNA翻译为含有与初始的mRNA相同的遗传信息的DNA,然后将它们作为间隔序列存储在CRISPR阵列中。这种过程能够多次发生,从而使得新的间隔序列以相反的时间顺序添加到CRISPR阵列,因此最近获得的DNA片段总是位于最前面,由此开发出一种存储转录事件的细胞记录设备。在此之前,Weixin Tang等人利用CRISPR构建出一种称为CAMERA(CRISPR-mediated analog multi-event recording apparatus)的细胞事件记录技术。[7]
最小的CRISPR基因编辑系统
2018年10月,Lucas B. Harrington等人发现了截止到当时最小的CRISPR基因编辑系统:在从科罗拉多州来复镇(Rifle)的一个有毒的净化场所获得的地下水样品中经过测序的古细菌基因组中发现了Cas14蛋白。与Cas9一样,Cas14具有作为生物技术工具的潜力。由于具有较小的体积,Cas14可能用于编辑小细胞或某些病毒中的基因。不过鉴于Cas14的单链DNA切割活性,它更有可能改善目前正在开发的用于快速诊断传染病、基因突变和癌症的CRISPR诊断系统。[7]
首例基因编辑婴儿
2018年11月26日,南方科技大学副教授贺建奎宣布,一对名为露露和娜娜的基因编辑婴儿于11月在中国诞生。[8]
FDA批准了CRISPR技术疗法
2018年12月1日,美国FDA批准了Editas Medicine公司开展使用CRISPR基因编辑技术治疗LCA10的临床试验。本次获批的是该公司在研疗法EDIT-101的IND申请,该疗法可能适用于一种遗传性视网膜衰退疾病——LCA10(Leber先天性黑朦症10型)。LCA是儿童遗传性失明的最常见原因,全世界每10万婴儿中就有2至3个病例。LCA的症状出现在生命的最初几年,会导致严重的视力丧失和潜在的失明。这种疾病由至少18个不同基因突变引起。其中最常见的疾病是LCA10,它是由CEP290基因突变引起的单基因疾病,在所有LCA患者中大约有20%至30%患有LCA10。
刚获得FDA批准的EDIT-101疗法,是一种基于基因编辑(CRISPR技术)的疗法。EDIT-101通过视网膜下注射给药,以到达基因编辑系统并将其直接输送到感光细胞中,从而达到治疗效果。
人类异种器官移植新突破
2018年12月5日,科学期刊《自然》发布了一篇论文,介绍了经过基因编辑的猪心脏移植进狒狒体内后正常存活超过半年。这意味着人类在异种器官移植(用手术的方法将某一种属个体的器官或组织移植到另一种属个体的某一部位)领域又迈出了关键性一步。[9]
首只基因编辑爬行动物
2019年4月,通过CRISPR基因编辑技术,两只白化蜥蜴在美国佐治亚大学的实验室诞生,这也是世界首只基因编辑爬行动物。日前,研究团队将论文发表在生物预印本网站。尽管CRISPR技术的出现让很多经基因编辑的物种乃至人类出现,但由于生殖过程的差异给CRISPR技术的应用造成障碍,基因编辑的爬行动物一直空缺。
在这项最新研究中,佐治亚大学的研究团队选择合适的时机,向沙氏变色蜥(Anolis sagrei)卵巢中的卵直接注射CRISPR组件。在146枚卵中,有9枚被成功编辑,最终两只白化的蜥蜴成功诞生。这项工作对于进一步理解爬行动物的演化与发育具有重要意义。[10]
基因编辑鸡细胞可阻断禽流感爆发
2019年6月,伦敦理工学院与爱丁堡大学的研究人员发现,用基因编辑技术对鸡的细胞蛋白进行修改,可以有效阻止禽流感病毒在鸡群中的传染和传播,为从源头上阻止禽流感病毒大规模爆发找到了新方法。[11]
首获三种更高精度单碱基编辑工具
2019年6月,中科院脑科学与智能技术卓越创新中心(神经科学研究所)杨辉研究组、四川大学郭帆研究组和中科院上海营养与健康研究所隶属的计算生物学研究所李亦学研究组合作,通过全转录组RNA测序首次发现,包括BE3、BE3-hA3A和ABE7.10等在内的DNA编辑工具单碱基编辑技术存在大量的RNA脱靶,并且ABE7.10还会导致大量的癌基因和抑癌基因突变,具有较强的致癌风险。研究人员通过点突变的方式对3种单碱基编辑工具进行突变优化,使其完全消除RNA脱靶的活性,首次获得3种更高精度的单碱基编辑工具,为单碱基编辑技术进入临床治疗提供了重要的基础。6月11日,相关成果在线发表于《自然》杂志。[12]
俄罗斯分子生物学家计划进行基因编辑婴儿试验
2019年6月,俄罗斯分子生物学家Denis Rebrikov宣布,他计划进行基因编辑婴儿试验,如果获得批准的话,年底之前就开始这项计划。如果计划得以实施,他就成为全球公开的第二名进行这一试验的人。[13]
美国计划进行在人体内部测试CRISPR基因编辑技术的研究
2019年7月,美国计划进行首项在人体内部测试CRISPR基因编辑技术的研究,这项研究计划使用CRISPR来治疗导致失明的遗传性眼部疾病。[14]
日本利用基因编辑技术改良了小麦特性
2019年8月,日本冈山大学宣布,其研究人员与同行合作利用基因编辑技术改良了小麦特性,使其遇雨也不易发芽。[15]
中国科研人员创制出油菜新株型
2019年8月,中国农业科学院油料作物研究所油菜分子改良理论与技术创新团队利用CRISPR/Cas9基因编辑系统敲除油菜BnaMAX1s基因,创制出新的优异株型种质,为油菜高产新品种培育提供了优异种质资源,油菜单株产量因此有望再提高约30%。这一最新研究成果在线发表于国际知名期刊《植物生物技术杂志》上。[16]
北大清华利用基因编辑技术治疗艾滋病的研究
2019年9月11日,北京大学-清华大学生命科学联合中心邓宏魁研究组、首都医科大学附属北京佑安医院吴昊研究组以及解放军总医院第五医学中心陈虎课题组在《新英格兰医学杂志》发表了题为《利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建》的研究论文。这意味着中国科研人员首次完成基因编辑干细胞治疗艾滋病和白血病患者。[17]
“先导编辑”技术突破“基因魔剪”局限
2019年10月21日,英国《自然》杂志发表一项研究:博德研究所科学家描述了一种新型多功能基因组编辑技术,能够增加可执行基因组编辑的类型。这项技术名为“先导编辑”(prime editing),可以避免DNA双链断裂,原则上可以修正约89%的已知与疾病相关的人类遗传变异体。[18]
美研究显示基因编辑细胞可在人体内长期存活
2020年2月,美国《科学》杂志上的一项研究显示,美国宾夕法尼亚大学的研究人员使用CRISPR/Cas9等方法多次编辑了从3名癌症患者血液中提取的免疫细胞,并将这些细胞注回患者体内。这些细胞在患者体内存活可达9个月。此前公开数据显示,这类细胞通常在体内生存不会超过一周。这也是美国首个基因编辑疗法的人体临床测试。[19]
首个 CRISPR 疗法患者体内给药完成
2020 年 3 月 4 日,Editas Medicine 和 Allergan 共同宣布,该临床试验完成了首例患者体内给药,AGN-151587 也是全球首款在患者体内给药的 CRISPR 基因编辑疗法。[20]
首个利用基因组编辑技术修复隐性致病突变成功案例
2020年6月,基因编辑领域的顶尖学者、Broad研究所的刘如谦(David Liu)教授与哈佛医学院专注于耳鼻喉科研究的Jeffrey Holt教授合作,在《科学》子刊发表一项新成果,为众多遗传性耳聋患者带来一种潜在治疗策略。他们利用新颖的单碱基编辑技术,在小鼠内耳中成功修正了导致耳聋的一种基因错误,让小鼠恢复部分听力。这是利用基因组编辑技术修复隐性致病突变的首个成功例子。[21]
基因编辑技术创制出高抗性淀粉小麦新种质
2020年12月,中国农业科学院作物科学研究所利用CRISPR/Cas9基因编辑技术,定点编辑敲除冬小麦品种“郑麦7698”和春小麦品种“Bobwhite”中的 SBEIIa 基因,分别获得了高抗性淀粉的冬、春小麦新种质,为培育营养功能型小麦新品种提供了新途径。相关研究成果在线发表于《植物生物技术杂志》。[22]
技术价值
 基因编辑(3)CRISPR正在生物医学研究领域引起一场巨变。不像其他基因编辑手段,它使用起来廉价、迅速且简单,并因此席卷全球实验室。研究人员希望利用它调整人类基因以消除疾病,创造生命力更加顽强的植物,并且消灭病原体。
基因编辑(3)CRISPR正在生物医学研究领域引起一场巨变。不像其他基因编辑手段,它使用起来廉价、迅速且简单,并因此席卷全球实验室。研究人员希望利用它调整人类基因以消除疾病,创造生命力更加顽强的植物,并且消灭病原体。
长久以来,生物学家一直在利用分子工具编辑基因组。他们因一种有望精确且高效地编辑基因、被称为锌指核酸酶的酶而兴奋不已。不过,需要花费5000多美元才能订购到的锌指并未被普遍采用,因为它们很难进行基因改造且花费颇高。CRISPR却大不相同:它依靠一种利用引导性RNA分子将其导向目标DNA、被称为Cas9的酶,然后编辑DNA以扰乱基因或插入想要的序列。通常,研究人员需要订购的只是RNA片段,其他成分都是现成的。全部花费只有30美元。这使得该技术走向大众化,因此每个人都在使用它。这的确是一场巨大的革命。[23]
CRISPR方法正快速超越锌指核酸酶和其他编辑工具。对一些研究人员来说,这意味着要放弃曾花费数年来完善的技术。研究人员传统上严重依赖诸如小鼠、果蝇等模式生物。CRISPR使在更多生物体中编辑基因成为可能。
遗传疾病治疗
基于其高度精准的特征,CRISPR的运用从理论上讲,可以修正任何遗传疾病的病因——突变,从而达到疾病治疗的效果。其具体运用可以分为体细胞基因编辑和胚胎基因编辑,前者是不可遗传的,后者如果能成功将会遗传给后代。Ma等报道了在植入前人类胚胎中纠正了MYBPC3基因(一种与显性肥厚型心肌病相关的基因之一)中的四碱基GAGT缺失。与以前的报道不同,这项新研究不仅使用了二倍体人类胚胎,而且还宣称提高了效率、准确性和减少了嵌合,从而为这种方法的临床应用开辟了新的基础。通过胞质内注射将Cas9蛋白和精子引入M期卵母细胞中,他们宣称嵌合体大幅减少并获得更有效的同源定向修复。然而,作者提醒说,需要进行更多的研究来证明其对于其他类型突变(例如碱基替换和更大片段的DNA删除、复制和回复)的可重复性和普遍性。尽管他们的研究取得了成果,但这种方法仅适用于对杂合突变的校正,因为修复显然依赖于同源的野生型拷贝,即母体等位基因,而不是合成的DNA模板。另一方面,根据动物研究和人类胚胎的初步报道,CRISPR/Cas9直接注射到受精卵中时,很难避免嵌合现象。不是胚胎的每一个细胞都必然携带所需的遗传改变,而且可能会在目标位点引入其他种类的突变。2018年11月26日,贺建奎宣布一对名为露露和娜娜的基因编辑婴儿于11月在中国诞生,引发了社会舆论高度关注。[24]显然,这一研究还处于非常早期的探索阶段,也备受领域同行质疑。
中国科技大学生命科学与医学部薛天教授研究组与中国科学院神经科学研究所仇子龙研究员研究组合作,结合视觉神经生物医学与创新基因编辑技术,首次通过同源重组修复方法在小鼠视网膜非分裂感光细胞中实现精准基因修复,让视网膜色素变性小鼠重获部分视觉功能。该研究成果于2019年4月17日在线发表于国际学术期刊《Science Advances》。科学家利用新型TRED基因编辑方法有效的实现了出生后非分裂细胞的同源重组基因矫正和相关器官功能修复,由于能够解决非分裂细胞内难以进行同源重组修复的限制,TRED有可能广泛应用于多种人类遗传疾病的在体治疗。[25]
罕见病治疗
胚胎水平的基因编辑临床应用,最大的受益方便是潜在的遗传性罕见病患者。胚胎基因编辑是治疗严重遗传性疾病最有效、最直接、最根本的治疗策略。使用基因编辑技术对人类胚胎进行基因组精确操作,不仅可以让带有严重遗传性疾病的高危个体顺利出生,使其自身终生摆脱该种遗传疾病,还可以将纠正后的正确基因序列传递给后代,让后代也尽可能地避免患上此种遗传病。与优生学目的不同,目前此类研究主要集中在诸如地中海贫血症、亨廷顿舞蹈症、镰刀型红细胞贫血症、血友病等对人类健康有重大威胁,并且尚无有效治疗方案的疾病。在涉足基因治疗领域的制药公司、生物医药初创企业的研发投入上,除肿瘤癌症类外,遗传病获得了较多的研究资源和经费。
2019年2月,Sangamo Therapeutics公司宣称在临床试验中完成第一次体内基因编辑,通过锌指核酸酶(ZFN)作为载体,将编码功能性酶的基因插入到患者的基因组上治疗Hunter(粘多糖症II型)或Hurler(粘多糖病I-H型)综合症。2017年,亚利桑那州的Brian Madeux成为第一个尝试这种治疗手段的人。通过静脉注射,他收到了许多修正基因的拷贝和锌指核酸酶的编辑工具,将其插入到他的DNA中。他和其他七名Hunter患者以及Hurler综合征患者的结果表明治疗是安全的,这是关于本次基因治疗早期实验的主要目标。[26]
胚胎学
人类胚胎的基因编辑也为理解早期人类发育提供了有价值的工具,英国和瑞典已经开展了这方面的工作(如NPR和卫报的报道),并在小鼠和其他物种中进行的工作为胚胎发育和多能性起源提供了概念性框架。然而,小鼠和人类胚胎发育的分子细节上存在着显著的差异,这些差异也可能在它们衍生的干细胞中出现。更好地了解早期人类胚胎的遗传回路将有助于寻找真正的“naive”人类多能干细胞。此外,人类胚胎的基因编辑可以帮助探索早期妊娠丢失和植入缺陷的遗传基础,特别是如果结合最近改进的人类囊胚培养方法。根据英国、美国和中国等国家的正式规则或非正式规范,科学家只允许培养人类胚胎至14 d。即使在这样的条件下,基因编辑也可以提供对植入后发育早期阶段(包括最早阶段)事件的深入了解。然而,将该规则延伸至14 d以上将开辟人原肠胚形成、胚层形成和体外生殖细胞发育等方面的研究,否则人类发育的各阶段是无法获得全面研究的。
植物抗病毒
脱靶(即对非目标位点的编辑)是CRISPR/Cas9系统应用于基因治疗和分子育种的一大弊端。2018年11月15日,研究人员在学术期刊Genome Biology 杂志发表了利用双生病毒(BSCTV)自身存在的一类病毒诱导型启动子,构建了一套新型的病毒诱导型基因组编辑系统VIGE (Virus-inducible genome-editing system)以期避免Cas9的持续表达,从而降低脱靶事件的发生。[27]
未来发展前景
未来的一个重要目标必须是提高核酸酶的安全性和特异性,提高检测脱靶事件的能力,掌握预防方法。ZFNs中使用的锌指很少完全特异,有些还可能引起毒性反应。对ZFN的切割结构域进行修饰可以降低毒性 。
此外,要加强对DNA重组和DNA修复机制的认识。
CRISPR的简易性和低成本,使得其获得广泛的研究和应用。由于其精确性和效率,CRISPR和TALEN都有望成为大规模生产中的选择。
技术争议
编辑人类基因的想法往往引发争议。英国禁止进行人体基因编辑。英国纳菲尔德生物伦理学协会副秘书长彼得·米尔斯向本报表达了对扮演上帝和“定制婴儿”的担忧。
一项对不能成活的人类胚胎开展的研究(在中国进行)因研究人员发现他们在临床环境下使用这种技术面临“严重障碍”而被叫停。
此外,在2015年3月,一个研究小组在《自然》杂志发表公开信,提出“严重担忧”编辑人类基因“种系”产生的道德和安全影响。
2018年11月,中国科学家贺建奎在深圳宣布,他们团队创造的一对名为露露和娜娜的基因编辑婴儿已顺利诞生。这对双胞胎的一个基因经过修改,使她们出生后就能天然抵抗艾滋病。这个世界首例基因编辑婴儿的横空出世,迎来了从科学家群体到普通民众对人类实施基因编辑伦理的正当性甚至事件真实性的普遍质疑 。
技术挑战
基因编辑技术可能被用于突破伦理道德底线的行为给大众带来了恐惧。尤其是使用CRISPR/Cas9操作人类胚胎的第一份报道发表后,更加深了各种情绪的碰撞,引发了世界范围的关于该技术在编辑人类基因组中潜在的应用的争论。这些情绪最终化为了行动,促成了由中、美、英三国4家最高级学术团体组织,并于2015年12月举行的人类基因编辑国际峰会。峰会成功举行后,由22位专家组成的研究小组深入研究了解人类基因组编辑的科学、伦理和监管。由此产生的报告建议继续支持基础研究,通过基因组编辑的新颖应用来探索生物学的新视野,以产生先前无法实现的知识,例如早期人类胚胎发育。报告强调了体细胞基因组编辑作为一种治疗工具预先存在监管框架的重要性,同时承认在治疗(维持或恢复特定的功能)和改善(超出个人最初预期的功能)之间划清界限的困难。然而,超越了此前的类似的论述,报告为处理可遗传的基因组编辑提供了一种宽容而非常谨慎的态度。该报告得出结论认为,在有限的一系列令人信服的情况下,进行可遗传的编辑在道德上是可以理解的,并且是允许的。总体而言,这些准则是一套明确的原则,任何希望从事研究和临床应用的国家都应该采用这一原则。除此之外,报告还强烈建议社会各界参与相关政策的讨论,以及就什么是符合伦理道德但超出了一个国家公共政策的限制范围的问题达成具有共识性的一致。自报告公布以来,已经在科学和大众媒体上进行了广泛的讨论和引用。
有效性挑战
CRISPR系统来源于细菌,包括人在内的哺乳动物体内并没有CRISPR系统及相似蛋白的存在,但人体内却存在针对Cas9蛋白的免疫应答机制。因此,在确保向人体或人类胚胎中引入外源CRISPR系统有效的同时,又不引起机体的强烈免疫应答,这些都是需要解决的问题。而且,外源CRISPR是否会对细胞或组织器官造成基因组之外的影响仍然缺少研究,特别是2018年CRISPR/Cas9与p53基因互有促进及抑制的报道,也引发了广泛的讨论。
截止到2018年,科学界并没有任何一种技术可以将所有sgRNA靶点区域出现的事件清晰地描绘出来,而对于更高维度的细胞、组织,甚至个体本身的影响依然缺乏有效的评估。
伦理与监管
在使用人类胚胎作为研究对象的国际规则和法规上存在着分歧,尽管在人类胚胎中进行体外基因组编辑可以帮助研究人员发现有关人类发育的宝贵知识。人类基因组编辑报告认为,可遗传的编辑是合乎道德的,但前提是必须符合严格的前置条件。这些前置条件包括在现有条件下没有合理的替代方案来预防严重的发育、生理缺陷,且存在强有力的监管力量以监督实施方案设计、执行以及长期的后续行动。
2018年12月14日,中国科学院院长白春礼联合美国国家医学院院长Victor J. Dzau、美国国家科学院院长Marcia McNutt在《科学》上发表一篇题为《来自香港的警示》社论,呼吁全球各国科学院携起手来,就基因编辑研究及临床应用所应遵循的准则达成广泛的国际共识。[28]
2019年3月,世界卫生组织在日内瓦宣布,将在未来两年内与相关利益攸关方广泛协商,制定一个强有力的人类基因编辑国际治理框架。世卫组织新成立的人类基因编辑全球治理和监督标准咨询委员会认为,现阶段开展人类生殖细胞系基因编辑的临床应用是“不负责任的”。按计划,委员会未来两年内将与包括患者群体、民间团体、伦理学家、社会学家等在内的利益攸关方进行一系列面对面和网络磋商,就制定人类基因编辑国际治理框架咨询意见。委员会一致同意应创建人类基因编辑研究的“中央登记体系”,以便为正在开展的工作建立一个开放、透明的数据库。[29]
2019年10月8日,澳大利亚政府的基因编辑技术新规定正式生效:澳大利亚政府将不会管制基因编辑技术在植物、动物和人类细胞系中的使用,但前提是不引入新基因材料。同时还增加了对基因驱动实验的监控。在基因驱动实验中,基因改造会在整个种群中传播,例如产生无菌蚊子。相关研究人员现在需要从OGTR获得许可证。[30]
法律规定
2020年12月26日,中华人民共和国刑法修正案(十一)规定“将基因编辑、克隆的人类胚胎植入人体或者动物体内,或者将基因编辑、克隆的动物胚胎植入人体内,情节严重的,处三年以下有期徒刑或者拘役,并处罚金;情节特别严重的,处三年以上七年以下有期徒刑,并处罚金。”自2021年3月1日起施行。[1]



 求购
求购









