- 小干扰RNA

小干扰RNA
简介
小干扰RNA(siRNA),有时称为短干扰RNA或沉默RNA,是一类双链RNA分子,长度为20-25个碱基对,类似于miRNA,并且在RNA干扰(RNAi)途径内操作。它干扰了表达与互补的核苷酸序列的特定基因的转录后降解的mRNA,从而防止翻译。
siRNA由双链RNA (double strand RNA, dsRNA) 在细胞内被RNase III (如Dicer) 切割成21~25bp大小的双链RNA。dsRNA可以是外源的, 如病毒RNA复制中间体或人工导入的dsRNA;也可以是内源的, 如细胞中单链RNA在RNA依赖的RNA聚合酶的作用下形成的dsRNA 。[1]
发现
siRNA最早是由英国的大卫·包孔博(David Baulcombe)团队发现,是植物中的转录后基因沉默(post-transcriptional gene silencing;PTGS)现象的一部分,其研究结果发表于《科学》。2001年,汤玛士·涂许尔(Thomas Tuschl)团队发现合成的siRNA,可诱导哺乳动物体内的RNAi作用,结果发表于《科学》。这项发现引发了利用可控制的RNAi,来进行生物医学研究与药物开发的方法。
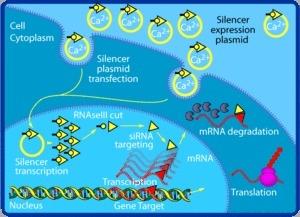 经由siRNA传达的RNA干扰机制
经由siRNA传达的RNA干扰机制
结构
siRNA具有明确定义的结构:具有磷酸化5'末端的短(通常20至24bp)双链RNA(dsRNA)和具有两个突出核苷酸的羟基化3'末端。该切酶酶催化生产的siRNA由长的dsRNA和小发夹RNA。siRNA也可以通过转染引入细胞。由于原则上任何基因都可以被具有互补序列的合成siRNA敲低,因此siRNA是在后基因组时代验证基因功能和药物靶向的重要工具。
siRNA通常是一段长21个核苷酸的双股RNA(dsRNA),其两股分别在RNA的两端超出另一端2个核苷酸,图示如下:
 每一股各有一个5'磷酸基末端与一个3'羟基末端。此结构是利用一种称为dicer的酶处理而得,这种酶可以将较长的双股RNA或小发夹RNA(small hairpin RNA)切成siRNA。此外,siRNA也可经由多种不同转染(transfection)技术导入细胞内,并对特定基因产生具专一性的敲弱(knockdown)效果。因此可利用经过适当剪裁的siRNA之互补性,来对已知序列的基因进行标定,这种现象使siRNA成为研究基因功能与药物目标的一项重要工具。
每一股各有一个5'磷酸基末端与一个3'羟基末端。此结构是利用一种称为dicer的酶处理而得,这种酶可以将较长的双股RNA或小发夹RNA(small hairpin RNA)切成siRNA。此外,siRNA也可经由多种不同转染(transfection)技术导入细胞内,并对特定基因产生具专一性的敲弱(knockdown)效果。因此可利用经过适当剪裁的siRNA之互补性,来对已知序列的基因进行标定,这种现象使siRNA成为研究基因功能与药物目标的一项重要工具。
siRNA机制
1.长dsRNA(可来自发夹,互补RNA和RNA依赖性RNA聚合酶)被称为Dicer的内切核糖核酸酶切割。Dicer切割长dsRNA以形成短干扰RNA或siRNA;这使得分子能够形成RNA诱导的沉默复合物(RISC)。
2.一旦siRNA进入细胞,它就会被整合到其他蛋白质中以形成RISC。
3.一旦siRNA是RISC复合物的一部分,siRNA就展开以形成单链siRNA。
4.由于其在5'末端的碱基配对而在热力学上较不稳定的链被选择作为RISC复合物的一部分。
5.作为RISC复合物一部分的单链siRNA现在可以扫描并找到互补的mRNA
6.一旦单链siRNA(RISC复合物的一部分)与其靶mRNA结合,它就会诱导mRNA切割。
7.现在切割mRNA并被细胞识别为异常。这导致mRNA的降解,并且反过来不将mRNA翻译成氨基酸然后转化为蛋白质。从而沉默编码该mRNA的基因。
siRNA也类似于miRNA,然而,miRNA来自较短的茎环RNA产物,通常通过抑制翻译来沉默基因,并且具有更广泛的作用特异性,而siRNA通常通过在翻译前切割mRNA而起作用,并且具有100%的互补性,因此目标特异性非常严格。[2]
用siRNA或其生物合成前体RNAi诱导
通过转染外源siRNA进行的基因敲低通常是不令人满意的,因为该效应仅是短暂的,特别是在快速分裂的细胞中。这可以通过产生siRNA的表达载体来克服。修饰siRNA序列以在两条链之间引入短环。得到的转录物是短发夹RNA(shRNA),其可以通过Dicer以其通常的方式加工成功能性siRNA。典型的转录盒使用RNA聚合酶III启动子(例如,U6或H1)来指导小核RNA(snRNA)的转录(U6参与基因剪接; H1是RNase)人RNase P)的成分。理论上,所得的siRNA转录物然后由Dicer处理。
通过使用细胞挤压也可以提高基因敲低效率。
RNAi中siRNA的活性很大程度上取决于其与RNA诱导的沉默复合物(RISC)的结合能力。双链体siRNA与RISC的结合之后是用内切核酸酶解开和切割有义链。然后剩余的反义链-RISC复合物可以与靶mRNA结合以启动转录沉默。
RNA激活
已经发现dsRNA还可以激活基因表达,这种机制被称为“小RNA诱导的基因激活”或RNAa。已经显示靶向基因启动子的dsRNA诱导相关基因的有效转录激活。使用合成的dsRNA在人细胞中证明RNAa,称为“小活化RNA”(saRNA)。目前尚不清楚RNAa是否在其他生物体中是保守的。
转录后基因沉默
siRNA诱导的转录后基因沉默始于RNA诱导的沉默复合物(RISC)的组装。该复合物通过切割编码靶基因的mRNA分子来沉默某些基因表达。为了开始该过程,两条siRNA链中的一条(引导链)将被装载到RISC中,而另一条链即过客链被降解。某些Dicer酶可能负责将引导链加载到RISC中。然后,siRNA扫描并指导RISC到mRNA分子上完全互补的序列。认为mRNA分子的切割由RISC的Argonaute蛋白的Piwi结构域催化。然后通过切割与siRNA残基10和11配对的靶核苷酸之间的磷酸二酯键精确切割mRNA分子,从5'端开始计数。这种切割导致mRNA片段被细胞核酸外切酶进一步降解。5'片段通过外来体从其3'末端降解,而3'片段从其5'末端通过5'-3'外切核糖核酸酶1(XRN1)降解。切割后靶mRNA链与RISC的解离允许更多的mRNA被沉默。这种解离过程很可能是由ATP水解驱动的外在因素促进的。
有时不会发生靶mRNA分子的切割。在一些情况下,磷酸二酯骨架的核酸内切裂解可以通过切割位点附近的siRNA和靶mRNA的错配来抑制。其他时候,即使靶mRNA和siRNA完全配对,RISC的Argonaute蛋白也缺乏内切核酸酶活性。在这种情况下,基因表达将被miRNA诱导机制沉默。
Ping-Pong方法的简化版本,涉及蛋白质Aubergine(Aub)和Argonaute-3(Ago3)切割piRNA的3'和5'末端。
Piwi相互作用的RNA负责转座子的沉默,而不是siRNAs。
siRNA的抗病毒治疗应用
近年来,RNAi技术在病毒感染性疾病治疗方面的应用已受到极大关注,尤其在AIDS、乙型肝炎和丙型肝炎等治疗中的应用研究最为活跃。目前,在siRNA抗AIDS的研究中,针对HIV结构蛋白基因及长末端重复序列(longterminal repeat,LTR)的SiRNA可以控制病毒复制;针对宿主细胞HIV受体CD4基因的siRNA可有效控制病毒进入宿主细胞,抑制病毒的感染过程。但CD4是人体正常免疫功能不可缺少的分子,它的表达抑制势必影响正常的免疫功能,由此设想针对CCR5、CCR4等共同受体设计siRNA,并正在试验中。另外在抗病毒治疗中,分别以丙型肝炎病毒、呼吸道合胞病毒、流感病毒、脊髓灰质炎病毒等基因组的编码区或非编码区为靶点设计的siRNA均取得了令人欣喜的体外抑制作用,但利用动物实验模型验证siRNA体内清除病毒的效果需进一步研究。[1]
虽然RNAi有望成为抗病毒治疗的有效工具,但病毒株靶基因的高度突变或碱基丢失,如HIV和流感病毒,成为设计siRNA时必须考虑的问题。另外一种称为病毒抑制子蛋白的发现使研究人员对RNAi的抗病毒效应有了更深的认识,研究发现这种病毒抑制子由病毒基因组编码产生,最初在植物中发现,目前有报道别的真核生物中也存在,其与RNA干扰装置竞争性的结合,通过阻断siRNA的加工或干扰信号的传递等途径抑制RNA干扰,从而降低其抗病毒的效应。[1]
针对上述影响因素,在RNAi抗病毒的治疗应用中,(1)靶序列的选择最好是针对病毒的保守序列,以减少病毒变异的影响。(2)设计针对不同靶序列的多种SiRNA并联合作用,以减少病毒逃逸的产生。(3)针对病毒进入细胞或病毒复制相关的宿主基因设计siRNA,如HIV受体CD4、CCR5等,这样即使病毒高度变异,其逃逸RNA干扰的几率也会大大降低。(4)针对病毒抑制子设计siRNA,可在一定程度上减少或避免病毒抑制子的产生,并且随着对RNA干扰的深入研究,将会有越来越多的相关报道。综上所述,RNAi在抗病毒治疗应用方面虽取得很大的突破,但其应用于临床还有待更深的研究。[1]



 求购
求购







