- 上皮内瘤变

上皮内瘤变
简介
1960年Richard首次将上皮内瘤变(intraepithelial neoplasia, IN)这一名词用于子宫颈黏膜鳞状上皮的癌前变化,它的正确涵义是强调这种癌前病变的本质是上皮内肿瘤的形成。而这种上皮内肿瘤的形成包含了二重意义。一不是癌,二是肿瘤形成还是一个过程,故称为“ 瘤变”(neoplasia)而不是肿瘤(neoplasma)。
详细介绍
1960年Richard首次将上皮内瘤变(intraepithelial neoplasia, IN)这一名词用于子宫颈黏膜鳞状上皮的癌前变化,它的正确涵义是强调这种癌前病变的本质是上皮内肿瘤的形成。而这种上皮内肿瘤的形成包含了二重意义。一不是癌,二是肿瘤形成还是一个过程,故称为“ 瘤变”(neoplasia)而不是肿瘤(neoplasma)。1970年Morson在结直肠癌前病变中采用上皮内瘤变的观点,因为结直肠在解剖上黏膜层包括黏膜肌层是没有淋巴管的。因此任何在形态上具有恶性细胞特征的改变,以往称为局灶癌、原位癌或黏膜内癌的病变并不具有浸润和侵袭的能力,这类肿瘤不会转移。只要肿瘤完整切除,就没有复发的顾虑。而当肿瘤穿透黏膜肌层侵入黏膜下层时,因为黏膜下层内具有淋巴管网,可以发生转移,这时才是名符其实的浸润性癌。因此上皮内瘤变这一名词应用于结直肠腺瘤细胞出现恶性细胞特征改变所带来新概念的重大临床意义有二:一是解除了那些还没有真正步入浸润性癌病人冠以患“癌”的恐惧和思想负担。二是告诫外科医师不要为那些还不是真正患有浸润性癌的病人施行肿瘤根治性切除手术。特别对肿瘤位于直肠的病人,绝对不应施行腹会阴切除永久性结肠造口术。
WHO在2000年出版的国际肿瘤组织学分类中明确对包括结直肠在内,还有子宫颈、阴道、胃、泌尿道、前列腺、乳腺等器官中肿瘤统一采用“上皮内瘤变”取代原来所用“异型增生”的名词。这意味着“上皮内瘤变”与“异型增生”是同义词,涵义是相同的。在结直肠肿瘤中主要分为二级,即低级别上皮内瘤变 (low intraepithelial neoplasia,LIN)和高级别上皮内瘤变 (high intraepithelial neoplasia,HIN)。原来的轻度和中度异型增生归属低级别上皮内瘤变,重度异型增生则属高级别上皮内瘤变。高级别上皮内瘤变与重度异型增生、 原位癌、 局灶癌、 黏膜内癌、 还有其他癌疑、 癌变趋势等等都是一回事,应该只有一个名词,就是高级别上皮内瘤变。采用上皮内瘤变的名词是要强调更准确地反映癌前病变在发展为浸润性癌之前上皮细胞形态学改变的本质及其科学的概念,从而更正过去长期由于沿用重度异型增生、癌疑、 原位癌、 局灶癌、 黏膜内癌、 癌变趋势等名词所引起的治疗过度及其带来的不良影响。简而言之,对于直肠腺瘤上皮内瘤变,不论是低级别或高级别,只须经内镜完整摘除或局部切除就已足够。
病变
结肠癌的癌前病变
过去十年对结肠癌的广泛研究表明结肠癌的发生与基因突变累积有关。
灶性迷离腺体
上皮性肿瘤最早出现的形态学变化是出现灶性迷离腺体组织学显示灶性迷离腺体的腺上皮增生变大,常有灶性异型增生,主要分成两型:一型是ACFs具有增生性息肉的特征与高频率的ras原癌基因突变相关,另一型是与APC基因突变相关的ACFs不典型增生。从ACF到腺瘤到癌的进展,体现了ACF在结直肠癌中的致癌作用。
腺瘤
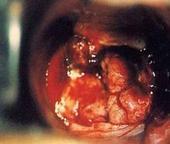 腺瘤是指出现上皮内瘤变。右半结肠腺瘤占40%,左半结肠占40%,直肠占20%。尸检发现30%~35%的个体有腺瘤存在。大体上多数息肉直径小于一厘米,可分为隆起型,平坦型和凹陷型。隆起型可以是带蒂的和不带蒂的,带蒂的有一长而不含增生性黏膜的茎与肠腔黏膜相连。平坦型不带蒂的和凹陷型腺瘤肉眼观局部肠黏膜呈红色,结构也略有不同,但不论有蒂或无蒂,腺瘤的表面均呈球样隆起。与正常黏膜相比,腺瘤在组织学上表现出细胞数目增多,体积增大,黏蛋白生成减少,细胞核染色质增粗,核层次增加并且失去极性,细胞核可呈梭形,增大或卵圆形,核分裂象增加,异型的细胞从腺体表面开始发生,在高度异型区域CEA呈局灶阳性。流式细胞仪检查发现有1/3的腺瘤为非整倍体。管状腺瘤常是隆起型,球型,带蒂或不带蒂,不典型增生的腺体至少占肠腔黏膜面的80%。绒毛状腺瘤通常无蒂,具有毛发样的外观,增生的腺体呈分叶状结构,不典型增生的腺上皮超过肠腔黏膜面的80%,绒毛状腺瘤的发生率与腺瘤的大小有关,腺瘤直径大于一厘米时,有76%为绒毛状腺瘤。区别绒毛状结构与狭长分离的管状结构有时是有点困难。绒毛状结构的诊断是腺体的长度超过正常肠黏膜厚度的两倍。绒毛-管状腺瘤呈混合性绒毛状和管状结构,两者比率在80%/20%和20%/80%之间。锯齿状腺瘤是指低倍镜下增生的息肉呈锯齿状,但在上隐窝部腺体和肠黏膜面上皮出现不典型增生。锯齿状腺瘤可以是管状和绒毛状,低度微卫星不稳定性和黏蛋白的改变是它的特征。一些绒毛状腺瘤的绒毛分支中可小的紧密的腺体,这些腺瘤可诊断为绒毛-微腺体腺瘤。有时在腺瘤中会发现有少量异型增生的腺体出现于黏膜肌层下方,常会误诊为恶变,需要加以鉴别,异型的腺体与腺瘤表面的腺体相似,异型腺体周围间质疏松,有炎细胞浸润,并可见黏膜肌包饶,周围有多量的含铁血黄素分布,总体形态与深在性囊性结肠炎的腺体相似等特征可资鉴别。APC/-catenin基因失活能够引发这个过程,从而导致肠陷窝基底部上皮异常增生的广泛上皮增生,并向肠腔内突出。息肉可能是由于ACP基因突变引起的肠腺窝融合积累的结果。上皮内瘤变可以是低度的也可以是高度的,取决于腺体或绒毛增生的复杂程度,细胞的层次和核的异型性,少数病例p53过度表达,而绝大部分病例bcl-2免疫组化染色强阳性。潘氏细胞,内分泌细胞和鳞状细胞增生在腺瘤中常可见到,可以作为上皮细胞的组成成分,有时在腺瘤间质中会出现骨化现象。
腺瘤是指出现上皮内瘤变。右半结肠腺瘤占40%,左半结肠占40%,直肠占20%。尸检发现30%~35%的个体有腺瘤存在。大体上多数息肉直径小于一厘米,可分为隆起型,平坦型和凹陷型。隆起型可以是带蒂的和不带蒂的,带蒂的有一长而不含增生性黏膜的茎与肠腔黏膜相连。平坦型不带蒂的和凹陷型腺瘤肉眼观局部肠黏膜呈红色,结构也略有不同,但不论有蒂或无蒂,腺瘤的表面均呈球样隆起。与正常黏膜相比,腺瘤在组织学上表现出细胞数目增多,体积增大,黏蛋白生成减少,细胞核染色质增粗,核层次增加并且失去极性,细胞核可呈梭形,增大或卵圆形,核分裂象增加,异型的细胞从腺体表面开始发生,在高度异型区域CEA呈局灶阳性。流式细胞仪检查发现有1/3的腺瘤为非整倍体。管状腺瘤常是隆起型,球型,带蒂或不带蒂,不典型增生的腺体至少占肠腔黏膜面的80%。绒毛状腺瘤通常无蒂,具有毛发样的外观,增生的腺体呈分叶状结构,不典型增生的腺上皮超过肠腔黏膜面的80%,绒毛状腺瘤的发生率与腺瘤的大小有关,腺瘤直径大于一厘米时,有76%为绒毛状腺瘤。区别绒毛状结构与狭长分离的管状结构有时是有点困难。绒毛状结构的诊断是腺体的长度超过正常肠黏膜厚度的两倍。绒毛-管状腺瘤呈混合性绒毛状和管状结构,两者比率在80%/20%和20%/80%之间。锯齿状腺瘤是指低倍镜下增生的息肉呈锯齿状,但在上隐窝部腺体和肠黏膜面上皮出现不典型增生。锯齿状腺瘤可以是管状和绒毛状,低度微卫星不稳定性和黏蛋白的改变是它的特征。一些绒毛状腺瘤的绒毛分支中可小的紧密的腺体,这些腺瘤可诊断为绒毛-微腺体腺瘤。有时在腺瘤中会发现有少量异型增生的腺体出现于黏膜肌层下方,常会误诊为恶变,需要加以鉴别,异型的腺体与腺瘤表面的腺体相似,异型腺体周围间质疏松,有炎细胞浸润,并可见黏膜肌包饶,周围有多量的含铁血黄素分布,总体形态与深在性囊性结肠炎的腺体相似等特征可资鉴别。APC/-catenin基因失活能够引发这个过程,从而导致肠陷窝基底部上皮异常增生的广泛上皮增生,并向肠腔内突出。息肉可能是由于ACP基因突变引起的肠腺窝融合积累的结果。上皮内瘤变可以是低度的也可以是高度的,取决于腺体或绒毛增生的复杂程度,细胞的层次和核的异型性,少数病例p53过度表达,而绝大部分病例bcl-2免疫组化染色强阳性。潘氏细胞,内分泌细胞和鳞状细胞增生在腺瘤中常可见到,可以作为上皮细胞的组成成分,有时在腺瘤间质中会出现骨化现象。
增生性息肉
过去常被误认为是正常黏膜或腺瘤性息肉,表现为无蒂,体积小,直径很少超过五毫米,组织学表现出特征性的伸长,锯齿状隐窝的腺上皮,基底部被覆增生的上皮,顶部由内折的上皮丛和增大的杯状细胞覆盖,在肠腔面形成锯齿状边缘。
在锯齿状区域,细胞核小,规则,圆形,靠近基底膜,细胞浆富含黏液,细胞体积大于正常的杯状细胞。上皮增生带的细胞增殖有丝分裂活动增多,这常常会误诊为腺瘤。传统上认为增生性息肉不是真性息肉,但是ras基因突变却经常发生,而且已证实存在克隆性增生,同时发现与结肠腺瘤及结肠癌相关的生物化学异常和流行病学,这些均提示增生性息肉可能是肿瘤性的。
幼年性息肉
偶发性幼年性息肉通常表现出典型的球形,分叶状和带蒂的外观,常具有错构瘤样改变。儿童常见,表面呈侵蚀性,易碎,切面常可见潴留性小囊。组织学表现为腺体扩张富含黏液,腺上皮呈立方形或柱状,间质由炎性肉芽组织构成。幼年性息肉综合征的息肉与偶发性息肉表现相似,但分叶状结构更明显,间质和扩张的腺体更少而小的增生性腺体更多。上皮内瘤变在偶发性腺瘤少见,若出现则可能存在与腺瘤相似的APC/β-catenin抑制基因突变。
Peutz-Jeghers息肉
(P-J息肉)P-J综合征包括在部分:胃肠道P-J息肉,常染色体显性遗传和皮肤黏膜黑色素沉着。男女发病率相等,多见于儿童和青少年,息肉最多见于小肠,其次为胃和大肠,息肉常为多发性,大小可从数毫米到五厘米,外形如腺瘤。组织学表现为由黏膜肌层和肌纤维增生形成树枝样结构,其上被覆消化道正常上皮,腺体和固有膜。黏膜与平滑肌保持正常的关系,一般认为P-J息肉为错构疚国。但有报道P-J息肉发生癌变并转移到淋巴结。同时P-J息肉可合并消化道其他部位癌,卵巢癌和子宫颈癌等,研究发现其与19号染色体上的LKB1(STK11)基因突变有关。
炎性息肉
这类息肉包括各种反应性上皮成分,炎性肉芽组织和纤维组织,形态学上与幼年性息肉相似。炎性息肉在各种慢性结肠炎中常见,包括慢性结肠炎和结肠憩室。
淋巴间质性息肉
淋巴间质性息肉含有反应性的黏膜相关淋巴组织,有淋巴滤泡形成一般位于黏膜或黏膜下层。
黏膜脱垂
偶尔黏膜脱垂可出现上皮内瘤变,表现出息肉状,团块状和溃疡形成,组织学表现为伸长,紊乱和再生的腺体,周围的黏膜肌增生呈束状伴有浅表糜烂,同时伴有炎性肉芽组织和纤维组织增生。常见肠黏膜表面的腺体扩张,这种现象包括炎症性泄殖腔源性息肉,实性直肠溃疡和帽状息肉,可出现于整个结肠段。
溃疡性结肠炎
慢性结肠炎中,结肠癌进展与上皮内瘤变(低度和高度)的进展是不同步的。癌变的部位可以是平坦的,或出现发育不良相关性损害和团块,后者常与在异型增生的上皮下同时发生癌变相关。DALM从结构上即可认为是高度病变。任何级别异型增生的DALM和高级主别的平坦型增生两者均与大约40%病人的浸润性癌有关,所以一旦确诊DALM和平坦型高度上皮内瘤变均需行全结肠切除术。在溃疡性结肠炎的病人,区别偶发性结肠腺瘤和DALM是困难的。
TOPO和Ki-67阳性表达UC相关性上皮内瘤变显著增加。Ki-67阳性细胞位于腺上皮的顶部和基底部,提示大部分的细胞增殖功能降低。与偶发性腺瘤相比,Tp53基因突变经常出现在UC相关性上皮内瘤变的病变中,并且是一个早期事件,但是在没有上皮内瘤变的愣是性炎症结肠上皮内也会出现Tp53基因突变。研究发现p16基因突变出现在早期UC病人中,而在腺瘤很少发生。对结肠癌和多个结肠肿瘤细胞系研究发一央9pl上存在LOH缺失。
微卫星不稳定和p16及p53基因突变可能是上皮内瘤变和腺癌形成过程的早期事件,这些改变能导致其他等位基因如APC和DCC缺失的易感性。研究发现LOH基因定位于3p接近VHL区域,在DALM损害中较常发生,而在平坦型上皮内瘤变损害中不常见。上述这些改变不常出现于偶发性腺瘤,提示UC相关性上皮内瘤变与偶发性腺瘤存在不同的基因突变途径。
克隆病
在克隆病相关性结肠癌中上皮内瘤变(包括低度和高度病变)占很大的比例,这种损害既可出现在浸润性病灶旁,又可出现在远隔肠黏膜上。与UC相似。克隆病息肉样上皮内瘤变亦诊断为DALM。克隆病发生黏液腺癌比偶发性结肠癌常见,并且肛周瘘管黏膜腺癌和肛管黏膜鳞状细胞癌的发病率也在不断增加。
与UC相似,p53和c-Kras基因突变在克隆病相关性上皮内瘤变比偶发性结肠癌的腺瘤-腺癌中更早检测到。
发病原因
 1.人类乳头状瘤病毒感染 近年来随着人类乳头状瘤病毒(HPV)感染与下生殖道关系研究的不断深入,发现HPV感染与子宫颈癌前病变的发生有着一定的关联。HPV感染作为一种特殊类型的性传播疾病是子宫颈上皮内瘤样病变发生的病因。分子生物学及流行病学研究表明人类乳头状瘤病毒有致癌性。HPV根据其致癌性不同可分为不同类型:HPV16,18,45,56为高危型,HPV31,33,35等11种为中危型,HPV6,11,26等8种为低危型。CINⅠ及亚临床HPV感染常为HPV6,11型,CINⅢ80%为HPV16型感染。
1.人类乳头状瘤病毒感染 近年来随着人类乳头状瘤病毒(HPV)感染与下生殖道关系研究的不断深入,发现HPV感染与子宫颈癌前病变的发生有着一定的关联。HPV感染作为一种特殊类型的性传播疾病是子宫颈上皮内瘤样病变发生的病因。分子生物学及流行病学研究表明人类乳头状瘤病毒有致癌性。HPV根据其致癌性不同可分为不同类型:HPV16,18,45,56为高危型,HPV31,33,35等11种为中危型,HPV6,11,26等8种为低危型。CINⅠ及亚临床HPV感染常为HPV6,11型,CINⅢ80%为HPV16型感染。
子宫颈重度不典型增生其细胞内染色体常伴有HPV基因的整合,从而启动E1、E2基因,导致病毒基因在宫颈上皮内的表达,其后E6、E7基因编码合成多功能蛋白从而干扰细胞生长,在16、18型高危的HPV感染者起着重要的细胞癌变作用。高危型HPV E6蛋白可与肿瘤抑制基因p53结合,导致p53降解,E7基因产物是一种核磷酸蛋白与肿瘤抑制基因retinoblastoma基因(PRb)产物结合导致其功能灭活,从而影响其抑制细胞生长的作用。
2.其他因素
(1)吸烟:吸烟与宫颈上皮内瘤样病变的发生有一定关系,其降解物尼古丁与致肺癌类似的宫颈刺激性,在宫颈上皮内瘤样病变的发生中起重要作用。
(2)微生物感染:淋球菌、单纯疱疹病毒(HSV)、滴虫感染可增加对HPV的易感性,从而与宫颈上皮内瘤样病变的发生有关。
(3)内源性与外源性免疫缺陷:免疫缺陷病毒的感染可致CIN的发生增加,如Hodgkin病、白血病、胶原性血管病与HPV感染性疾病发生有关。
发病机制
1.宫颈不典型增生 鳞状上皮不典型增生细胞既具有异型性,又保持分化能力。镜下特点为:①细胞核增大、深染,大小形态不一;②染色质增多、粗大;③核浆比例增大;④核分裂增多;⑤细胞极性紊乱至消失。根据细胞异型程度及上皮累及范围,宫颈不典型增生又分为轻、中、重三度(或三级)。
(1)轻度不典型增生(或称Ⅰ级):细胞异型性轻,异常增生的细胞仅限于上皮层的下1/3,中、表层细胞正常。
(2)中度不典型增生(或称Ⅱ级):细胞异型性明显,异常增生的细胞限于上皮层的下2/3,未累及表层。
(3)重度不典型增生(或称Ⅲ级):细胞异型性显著,异常增生的细胞占据上皮内2/3以上或达全层。
2.宫颈湿疣 组织学上分3类:①外生型,镜下呈乳头状生长;②内生型,上皮向间质内生长;③扁平型,最为常见,缺乏上述二型的特点,但细胞具有不典型改变,易误认为CIN。
Meisels等曾首先描述的主要镜下特点为:
(1)上皮中表层出现挖空细胞,细胞增大,核呈现异型性,可见双核或多核,核周胞浆中有不规则的空晕区域,而外周的胞浆致密。
(2)棘细胞增生。
(3)表层可见过度角化或不全角化细胞。
(4)间质乳头状增生向表面突起。其中挖空细胞是HPVI最典型的表现。1981年该作者又指出挖空细胞是湿疣和不典型增生的主要鉴别点,并详细描述挖空细胞的组织学表现。
3.宫颈原位癌
(1)宫颈原位鳞癌的基本特点:癌细胞仅限于上皮内,基底膜完整,无间质浸润。病理特征为:①细胞排列紊乱,无极性;②细胞核大,核浆比例增大;③核异型性大,染色深浅不一;④异常核分裂象多见,在上皮各层均可发现。
(2)根据发生部位形成3类不同的细胞类型:①大细胞角化型;②大细胞非角化型;③小细胞型。原位癌累及腺体十分常见,仍具有基底膜完整而无间质浸润的特点。原位癌累及腺体是指不典型增生的鳞状上皮细胞向基底部伸展,累及宫颈管黏膜中的腺体颈部,肿瘤边界清晰,周围间质无炎性反应,并可见残留的高柱状腺管上皮。如累及的腺体明显膨大、变形或互相融合、细胞分化不良时易发生浸润,应予重视,需与镜下浸润鉴别。
(3)由Friedll和Mckay描述的原位腺癌的病理特征为:
①常发生于颈管下段移行带附近。
②也可局限于一个宫颈管黏膜息肉内。
③可累及成组的腺体结构或单个腺体,呈芽状生长入间质,使腺体呈筛状改变,由上皮细胞构成的乳头亦可穿入腺体内或突出于颈管表面,但并非浸润。
④原位腺癌由假复层柱状上皮构成(舒仪经等,1995)。
4.CIN分级
(1)CIN根据细胞的异型程度也分为三个级别:
①CINⅠ级:相当于极轻度和轻度不典型增生。
②CINⅡ级:相当于中度不典型增生。
③CINⅢ级:相当于重度不典型增生和原位癌。
(2)最近有作者提出根据CIN细胞的成熟程度分为三个亚型:①角化型;②非角化型;③小细胞型。认为这一分类将提供一个较完善的使组织病理学和细胞病理学相互联系的形态学基础,并与宫颈癌的致癌机制的设想途径相关。
CINⅠ:上皮成熟,核异常少,有丝分裂少。未分化的细胞限于上皮深层(下1/3)。有丝分裂象可见,但不多,HPV感染的细胞病理变化在全层上皮均可观察到。
CINⅡ:不典型增生的细胞变化主要在上皮下的1/2或1/3,核异常比CINⅠ明显。上皮下1/2可见到核分裂象。
CINⅢ:上皮分化和分层可以缺乏或仅在上皮表层的1/4出现并伴有许多核分裂象,核异常可遍布上皮全层,许多核分裂象有异常。
细胞学者、病理学者和阴道镜学者互相沟通可提高三个级别CIN的报告水准。尤其有助于鉴别轻度CIN。
西医治疗方法
手术治疗:根据细胞学、阴道镜以及宫颈活组织检查结果决定治疗方法。
CINⅠ:约30%CINⅠ发展为HSIL或宫颈浸润癌,因此需切除可见病灶。对范围小、局限的病灶可采用冷冻治疗(有效率约95%);范围较大、病灶扩展到阴道(片状或卫星状),或累及腺体的病变可采用激光治疗(有效率约93%)。病灶切除深度应达粘膜下约6~7mm,以便排除宫颈浸润癌。
对无明显病灶,且可随访者可先按炎症处理,2~3月后重复作宫颈刮片细胞学检查,必要时再次活检。
CIN Ⅱ:可用冷冻治疗(有效率约94%左右)。病变范围大可选用激光治疗(有效率约92%)或宫颈锥形切除病灶。
CIN Ⅲ:无生育要求者行子宫全切除术。年轻、希望生育者可行宫颈锥形切除术,术后密切随访。
诊断检查
 1.细胞学检查 自1941年Papanicloaou和Traut创立用阴道脱落细胞学诊断方法以来,长期的临床实践证明此法具有简便易行、经济有效及多次重复的特点,已成为妇科常规检查的重要内容及宫颈癌普查中首选的初筛工具。从临床角度来看以下几点值得重视:
1.细胞学检查 自1941年Papanicloaou和Traut创立用阴道脱落细胞学诊断方法以来,长期的临床实践证明此法具有简便易行、经济有效及多次重复的特点,已成为妇科常规检查的重要内容及宫颈癌普查中首选的初筛工具。从临床角度来看以下几点值得重视:
(1)诊断的正确率:细胞学阳性确诊率虽达95.4%,但不同作者报道的准确率差异很大(67%~92.6%),且有一定的假阴性和假阳性。检出CIN的假阴性为10%~35%,甚至高达50%(Coppleson,1992)。细胞学诊断的准确性主要取决于以下因素:
①取材部位:是影响涂片质量的关键,常规在宫颈外口的鳞柱交界处取材,但因有一定比例的宫颈癌起源于颈管,特别是腺癌及绝经前、后妇女或宫颈局部治疗后鳞柱交界上移,故应重视宫颈管部位的取材。目前主张双份涂片法(即同时取宫颈和颈管涂片)及重复涂片,有助于提高涂片质量和阳性率。有学者报告随机采用宫颈“双取器”及小脚板取材,二者比较结果显示异常细胞检出率有显著差异,分别为85.7%和42.8%。“双取器”具有使用方便、一次完成双份涂片的优点,但在宫颈萎缩时颈管取材困难。上海有采用小戟式刮板的,认为适用于老年患者。有研究发现,常规涂片有80%以上的细胞随取材器被丢弃,可见细胞学的取材工具还需改进。
②加强质量控制,提高制片、染色技术及诊断水平:涂片质量差影响诊断的正确性,占40%。液基细胞学几乎保留了取材器上的全部标本,制成的薄层涂片提高了涂片质量,便于阅片观察。
(2)统一诊断标准,应用新的报告方式(TBS):长期以来国内外大多采用传统的巴氏五级分类法,随着细胞病理学的进展,在开阔阴道细胞学诊断范围中逐渐感到巴氏分级法已不能适应疾病的诊断和临床要求。1988年WHO提出应用描述性报告和与CIN一致的报告系统,同年美国国立癌症研究所提出Bethesda系统TBS报告方式,在临床实践中正逐步完善此报告系统。
(3)宫颈湿疣的诊断:20世纪70年代后期逐渐认识,Meisels(1981)提出不典型湿疣是癌前病变,细胞学检出湿疣的阳性率低,普查中湿疣的检出率为3%~4%,Meisels(1992)报告普查中湿疣占3.23%,不典型湿疣占0.57%。湿疣的细胞学形态与CIN相似,其空穴细胞易误认为癌细胞,不典型湿疣常误诊为浸润性角化性癌,应予重视,注意识别。湿疣的细胞学特征为:
①核周空穴细胞或挖空细胞。
②角化不良细胞。
③湿疣外底层细胞。
(4)重视宫颈腺癌的细胞学诊断:多数人认为宫颈腺癌不易早期发现、早期诊断,大多是在细胞学预示CIN后组织学检查才意外发现。细胞学诊断腺癌的阳性率低,为48%左右,近年报道细胞学的阳性预测值为71%~79%(Laverty,1988),常规刮取宫颈外口及颈管涂片可能会提高腺癌的检出率。
2.涂抹醋酸肉眼观察(VIA) VIA是指宫颈表面涂抹3%~5%醋酸溶液后,无放大条件下肉眼直接观察宫颈上皮对醋酸的反应程度。根据醋白上皮的厚薄、边界轮廓和消失的快慢等作判断,20世纪90年代后已用于发展中国家和经济落后地区的宫颈癌筛查,Belinson等(2001)报告VIA在宫颈癌筛查中的灵敏度和特异度分别为70.9%和74.3%,此法简便易行,经济有效。
3.碘溶液试验 又称为Schiller试验。是将碘溶液涂在宫颈上观察其染色的部位。正常子宫颈鳞状上皮含糖原,糖原与碘混合后产生深赤褐色或深棕色,不染色为阳性。宫颈炎、宫颈癌前病变及宫颈癌的鳞状上皮缺乏糖原或不含糖原,涂碘后不染色,有助于定位异常上皮,识别危险的病变,以便确定该组织检查取材的部位。
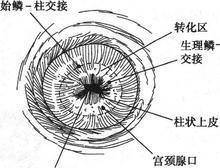
子宫颈异常部位确定后应确定其外周及远端的边界。通过上述溶液的应用,阴道镜下通常可识别其病变下极,但偶尔病变可延伸至阴道穹隆。病灶的上缘可用阴道镜观察其鳞柱交界处。
1.阴道镜检查及阴道镜引导下的活检
(1)阴道镜检查:阴道镜检查是一种简单而有效的诊断子宫颈有无病变的方法,肉眼不能看出的异常上皮及异常毛细血管,通过阴道镜检查可清楚地看到。阴道镜下异常上皮的特征包括:
①细胞和细胞核密度的增加。
②鳞状上皮轮廓不规则,并伴有特殊的血管变化,表现为点状(punctation)或镶嵌(mosaic)。前者是由于上皮内扭曲或弯曲的毛细血管斜行达表面,后者是由于血管扩张,排列成蜂窝状,内上皮岛分开而成。
③白色上皮是CIN的第一特征,在上皮表面有一层厚的角化蛋白。
阴道镜检查能进一步帮助发现病变部位,从而指导宫颈部位正确活检,但不能区别原位癌与不典型增生。阴道镜检查结果正确与否与是否全面观察到移行带有关。
(2)阴道镜引导下宫颈活检:子宫颈活检是诊断CIN最可靠的方法,在阴道镜引导下对可疑部位行多点活检是明确CIN诊断的最好方法,取下的活检组织应有足够深度,包括鳞状上皮并有足量的间质组织,最好能取到其周围组织。
2.宫颈活检及颈管刮术 CIN和宫颈癌的诊断必须依据宫颈活体组织的病理检查。
宫颈活检时需注意以下几点:①宜在碘染、VIA或阴道镜下进行多点活检,分别标记送病检;②取材包括病灶及其周围组织;③咬取宫颈上皮及足够的间质组织;④临床或细胞学可疑时应重复取活检或切取活检。
颈管刮术(ECC):刮取颈管内膜组织送病理检查,有助于明确颈管内有无病变和CIN或癌是否累及颈管,但是否作为常规检查目前尚无一致意见。颈管刮术的指征为:①细胞学异常或临床可疑的绝经前后妇女,尤其怀疑腺癌时;②阴道镜下病变累及颈管;③细胞学多次阳性或可疑,阴道镜检查阴性或不满意或阴道镜下活检阴性者。
3.宫颈锥形切除 是宫颈癌传统可靠的诊断方法,由于阴道镜的广泛开展,诊断性锥切率明显下降。20世纪90年代,国外有几组报道比较阴道镜下活检和锥切活检在诊断CIN和浸润癌中的作用,结果相当(Coppleson,1992)。诊断性锥切指征为:
(1)细胞学多次阳性,阴道镜检查正常或看不到全部转化区或阴道镜下活检和ECC阴性者。
(2)细胞学报告与阴道镜下定位活检或颈管刮术结果不符。
(3)VIA或阴道镜下活检疑有早期浸润。
(4)级别较高的CIN病变延伸至颈管内。
(5)怀疑腺癌者。临床或阴道镜检查可疑浸润癌者为手术禁忌证。
4.宫颈环形电切术(LEEP)和大环状宫颈转化区切除(LLETZ) 自20世纪90年代后较广泛地应用于CIN的诊治,故也具有诊断和治疗的双重作用。

-
奥迪a6变远光没有反应
2025-09-23 05:27:15 查看详情 -
互感器伏安变比极性综合测试仪
2025-09-23 05:27:15 查看详情


 求购
求购







