- B族链球菌

B族链球菌
定义
 B族链球菌(3)1938年Fry首次报告3例感染B族链球菌引起产后心内膜炎的死亡,证实B族链球菌为人类的致病菌。经过几十年的研究,发现B族链球菌可引起新生儿败血症、肺炎、脑膜炎,甚至死亡。在感染后存活的新生儿,还有可能有严重的神经系统后遗症,包括脑积水、智力障碍、小头畸形、耳聋等。同时,B族链球菌还可引起孕妇感染、引起早产、胎儿发育不良(低体重儿)、胎膜早破及晚期流产。
B族链球菌(3)1938年Fry首次报告3例感染B族链球菌引起产后心内膜炎的死亡,证实B族链球菌为人类的致病菌。经过几十年的研究,发现B族链球菌可引起新生儿败血症、肺炎、脑膜炎,甚至死亡。在感染后存活的新生儿,还有可能有严重的神经系统后遗症,包括脑积水、智力障碍、小头畸形、耳聋等。同时,B族链球菌还可引起孕妇感染、引起早产、胎儿发育不良(低体重儿)、胎膜早破及晚期流产。
鉴于该菌引起的感染不只限于牛乳房炎,其细胞壁中多糖物质又属于抗原构造分类中的B族,故目前一般采用B族链球菌(group B streptococcus,GBS)来替代无乳链球菌原名。
国内外筛检现状
 B族链球菌目前,国内外对于GBS的预防方案都主要采用的是抗生素预防。但是近几年来,全球GBS的耐药性逐年上升。
B族链球菌目前,国内外对于GBS的预防方案都主要采用的是抗生素预防。但是近几年来,全球GBS的耐药性逐年上升。
1998年-2001年间,美国及加拿大地区,GBS对红霉素的耐药性由7%上升至25%,2003年达到37%。在我国,广州地区1999年分离的GBS菌株对红霉素和林可霉素耐药率即分别达到45%和26%,这与国内抗生素的滥用密不可分。
在GBS的治疗过程中,由于妊娠妇女带菌率大约为10%-30%,对于全部妊娠妇女注射抗生素的预防方法显然会导致抗生素不必要的使用。因此在孕妇产前进行GBS筛检显得尤为必要。
国外围产期GBS筛检现状
目前国外对于孕妇是否进行抗生素预防一般采用两种评估策略:基于风险评定的策略和基于GBS筛检的策略。通过对比两种不同策略实施效果可以得出结论:采用对GBS进行常规筛检策略比通过风险评定策略更能有效的降低婴儿早期侵入性感染的发生率。
GBS筛检的策略决定,对于怀孕35-37周的孕妇都必须进行阴道和直肠的GBS筛检。
1996年美国疾病控制中心(CDC)与其他机构共同制定了《围产期B族链球菌感染筛查及防治指南》,并于2002年和2010年进行了修改,很大程度上减少了围产期B族链球菌感染的发生率和危害,发病率从90年代早期1.7/1000个新生儿降低到了近些年的0.34-0.37/1000个新生儿。
国内围产期GBS筛检现状
我国GBS产前筛检现状
长期以来我国对GBS的感染现状重视不够,然而近期国内报道了一些GBS感染导致死亡的病例,邓江红等对北京儿童医院234例感染肺炎死亡的新生儿肺部组织石蜡标本进行了GBS检测,其检出率为65%,该结果显示新生儿肺炎死亡病例中,GBS是第一位的致病菌。
再者,由于国内抗生素的滥用,使得全国范围对围产期GBS的筛检几乎空白,如今国家不断的出台相关的政策,对抗生素的临床应用与管理进行严格监控,加之GBS的危害比较严重,这使得GBS的筛检尤为重要且必要。
国内围产期GBS感染的预防工作可以借鉴美国CDC2010年发布的GBS预防指南,对于怀孕35-37周的孕妇进行阴道和直肠的GBS筛检,这样能够提高预防效率,节省资源,同时能够大量减少不必要的抗生素使用。
泰普GBS筛检方案
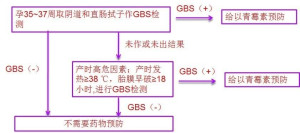 泰普GBS筛检方案
泰普GBS筛检方案
检测GBS的临床意义
GBS,正常寄居于阴道和直肠,它是一种条件致病菌,一般正常健康人群感染GBS并不致病。
据统计约10%~30%的孕妇有感染GBS,其中40%~70%在分娩过程中会传递给新生儿。如果新生儿带了这种菌,大约有1%~3%会出现早期侵入性感染,其中有5%会导致死亡。
GBS感染诱发产妇多种疾病
孕妇感染表现为菌血症、泌尿系统感染、胎膜感染、子宫内膜感染以及创伤感染。
GBS感染是胎膜早破的主要因素
GBS对绒毛膜有较强吸附能力和穿透能力,接种2小时内即可吸附于母体组织,继而侵入绒毛膜,通过炎症细胞的吞噬作用及细菌产生的蛋白水解酶的直接侵袭,使胎膜局部张力减低,从而导致胎膜早破。有报道显示,在2745例产妇中,尿中有感染GBS的胎膜早破发生率为35%。
GBS感染极易引起羊膜腔感染
据研究报道GBS阳性的孕妇中有21%发生绒毛膜羊膜炎和产后子宫内膜炎,分析表明GBS阳性是引起绒毛膜羊膜炎的重要危险因素。
GBS感染诱发早产率最高达60%
研究表明,GBS阳性孕妇早产合并低出生体重儿、极低体重儿的可能性增加20%-60%。
GBS是产褥感染的主要致病菌
产褥感染是指分娩时及产褥期生殖道受病原体感染,引起局部和全身的炎性应化。产褥感染发病率为1%~7.2%,是产妇死亡的四大原因之一。GBS是造成产褥感染的主要致病菌。
新生儿感染GBS诱发多种疾病甚至死亡
GBS传播的主要途径为垂直传播,且与分娩有关,如果孕妇感染GBS,新生儿就可能在出生时吸入感染的羊水或通过产道时感染GBS。刨宫产不能避免新生儿感染GBS。
*此图为GBS阳性的孕妇中新生儿的感染率
新生儿的感染根据感染时间可以分为早期侵入性感染(出生7天以内)、晚期侵入性感染(出生7天以后)。
新生儿感染GBS主要表现为早期侵入性感染,早期侵入性感染以新生儿败血症为主要临床表现。
新生儿感染GBS能够导致败血症,肺炎和脑膜炎,发病率和死亡率较高,也可能遗留长期病理状态如耳聋、视力受损、发育障碍以及脑瘫等。
依据美国新哈芬地区10年调查统计结果,其新生儿败血症年发生率为千分之二点七。其新生儿败血症有一半左右都是因B族链球菌感染引起的。
基于GBS感染引起孕妇和新生儿相关症状、疾病的严峻性,产前筛查GBS显得尤为重要。而分娩传播是新生儿感染GBS的主要途径。因此通过抗生素预防能够有效降低GBS垂直传播引发新生儿早期侵入性感染。
GBS的现代分子生物学检测
GBS筛检方法对比
| 方法 | 优点 | 缺点 |
| 传统培养法 | 易开展 | 耗时长,48h以上GBS培养难度高,灵敏度低 |
| 免疫试验法 | 操作简便 | 需培养后进行,时间长,灵敏度低 |
| 微生物自动分析鉴定系统 | 全面的自动化 | 时间长,成本高,设备昂贵 |
| 荧光PCR法 | 快速3h内出结果灵敏度高特异性强重复性好 | 需有PCR实验室 |
实时荧光PCR技术
| 方法 | 优点 | 缺点 |
| 传统培养法 | 易开展 | 耗时长,48h以上GBS培养难度高,灵敏度低 |
| 免疫试验法 | 操作简便 | 需培养后进行,时间长,灵敏度低 |
| 微生物自动分析鉴定系统 | 全面的自动化 | 时间长,成本高,设备昂贵 |
| 荧光PCR法 | 快速3h内出结果灵敏度高特异性强重复性好 | 需有PCR实验室 |
泰普生物GBS核酸检测试剂盒
实时荧光PCR一般流程:
快捷的操作流程:3小时
实时荧光PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号的积累实时监测整个PCR进程,最后通过扩增曲线对模板进行分析的方法。随着实时荧光PCR技术与相关PCR仪的出现,彻底改变了以往利用末端法对基因进行检测的方法。这种实时荧光PCR技术较传统的方法有如下的优势:
1)缩短实验时间,不需要进行PCR后的电泳跑胶鉴定;
2)由于数据的采集与分析都由仪器完成,不再依靠肉眼观察电泳的结果,所以检测的灵敏度与重复性大大提高;
3)由于实时荧光PCR后无需开盖,所以可以非常好地防止污染的发生。
国外研究也显示,实时荧光PCR检测方法与标准的细菌培养方法在GBS检测的敏感性和特异性方面均达90%以上,达到筛检标准,已经得到美国食品和药品管理局(FDA)的批准并应用于临床。因此,在国内采用实时荧光PCR技术进行GBS筛检是最快速、可靠的方法。
产品预期用途
产品特点
 B族链球菌(6)本试剂盒基于实时荧光PCR技术平台,采用分子信标(Molecular Beacons)探针技术和特异引物技术,适用于临床样品中GBS的快速检测,可用于GBS感染的辅助诊断及疗效监控。
B族链球菌(6)本试剂盒基于实时荧光PCR技术平台,采用分子信标(Molecular Beacons)探针技术和特异引物技术,适用于临床样品中GBS的快速检测,可用于GBS感染的辅助诊断及疗效监控。
药物预防及治疗
国内独家、技术领先;自主研发、专利技术;灵敏性高、特异性强;简便快捷、重复性好;
闭管操作、避免污染。
GBS感染的防治
预防GBS感染主要集中于从母婴双方消除GBS带菌状态(药物预防)着手或给新生儿保护性免疫(主/被动)。
免疫预防
青霉素一直以来作为预防治疗GBS感染的首选药物,目前最常用的预防及治疗方法是用青霉素G首剂500万单位静脉注射,每4—6小时250万单位;或氨苄青霉素首剂2g静脉注射,每4—6小时1g,直至分娩。
博尔诚GBS核酸检测试剂盒
导致围产期GBS感染的菌株分型不多,有针对性的进行疫苗研制,无疑是经济有效的防治手段。此外,还可减少抗生素的使用,从而减少GBS耐药性的发生。
目前,国外对孕32—34周的妇女已有采用特异GBS疫苗接种的报道,使其产生IgG抗体,证实可预防90%的新生儿感染及母亲产后GBS感染。
生活中如何预防阴道细菌感染
 博尔诚GBS核酸检测试剂盒产品预期用途
博尔诚GBS核酸检测试剂盒产品预期用途
| 注册号 | 国食药监械(准)字2013第3400105号 | 产品名称 | B族链球菌(GBS)核酸检测试剂盒(PCR-荧光探针法) |
|---|---|---|---|
| 生产单位 | 博尔诚(北京)科技有限公司 | 地址 | 北京市北京经济技术开发区永昌北路甲7号4幢三层 |
| 产品标准 | YZB/国 6709-2012 | 产品性能结构及组成 | DNA提取液、GBS PCR反应液、GBS阳性对照品、空白对照品产品有效期:-18℃以下避光保存,6个月。 |
| 产品适用范围 | 适用于妊娠34-37周孕妇生殖道分泌物及直肠分泌物样本中的B族链球菌(GBS)DNA的定性检测。 | 规格型号 | 20 人份/盒 |
| 批准日期 | 2013.01.21 | 有效期 | 2017.01.20 |
| 变更日期 | 生产场所 | 北京市北京经济技术开发区永昌北路甲7号4幢3层 | |
| 邮编 | 附件 |
[3]
词条图册
| 注册号 | 国食药监械(准)字2013第3400105号 | 产品名称 | B族链球菌(GBS)核酸检测试剂盒(PCR-荧光探针法) |
|---|---|---|---|
| 生产单位 | 博尔诚(北京)科技有限公司 | 地址 | 北京市北京经济技术开发区永昌北路甲7号4幢三层 |
| 产品标准 | YZB/国 6709-2012 | 产品性能结构及组成 | DNA提取液、GBS PCR反应液、GBS阳性对照品、空白对照品产品有效期:-18℃以下避光保存,6个月。 |
| 产品适用范围 | 适用于妊娠34-37周孕妇生殖道分泌物及直肠分泌物样本中的B族链球菌(GBS)DNA的定性检测。 | 规格型号 | 20 人份/盒 |
| 批准日期 | 2013.01.21 | 有效期 | 2017.01.20 |
| 变更日期 | 生产场所 | 北京市北京经济技术开发区永昌北路甲7号4幢3层 | |
| 邮编 | 附件 |

-
Edition上市 全新奔腾B70官图曝光
2025-09-21 12:56:25 查看详情 -
吉利缤越PRO家族正式上市 大众ID.7第二季度全球首发
2025-09-21 12:56:25 查看详情 -
一汽奔腾B2 大众捷达VS7黑锋版亮相
2025-09-21 12:56:25 查看详情 -
一汽丰田bZ3正式发布 一汽奔腾B70十五周年经典版上市
2025-09-21 12:56:25 查看详情 -
一汽奔腾B2 将于4月27日正式上市
2025-09-21 12:56:25 查看详情 -
一汽奔腾B70十五周年经典版上市 工况法最大续航565km
2025-09-21 12:56:25 查看详情 -
一汽奔腾B2 一汽奔腾全新MPV预计广州车展上市
2025-09-21 12:56:25 查看详情 -
一汽奔腾B70十五周年经典版上市 一汽奔腾规划全新轿车
2025-09-21 12:56:25 查看详情 -
一汽奔腾B2 一汽丰田全新MPV或将于9月上市
2025-09-21 12:56:25 查看详情


 求购
求购

