- g蛋白耦联型受体

g蛋白耦联型受体
简介
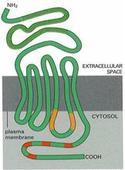 G蛋白耦联型受体为7次跨膜蛋白,因此亦有人将此类受体称为七次跨膜受体。受体本身不具备通道结构,也无酶活性,它是通过与脂质双层中以及膜内侧存在的包括G蛋白等一系列信号蛋白质分子之间级联式的复杂的相互作用来完成信号跨膜转导的,因此也称促代谢型受体。[1]
G蛋白耦联型受体为7次跨膜蛋白,因此亦有人将此类受体称为七次跨膜受体。受体本身不具备通道结构,也无酶活性,它是通过与脂质双层中以及膜内侧存在的包括G蛋白等一系列信号蛋白质分子之间级联式的复杂的相互作用来完成信号跨膜转导的,因此也称促代谢型受体。[1]
G蛋白耦联型受体包括多种神经递质、肽类激素和趋化因子的受体,在味觉、视觉和嗅觉中接受外源理化因素的受体亦属G蛋白耦联型受体。
组成
受体
 受体在结构上均为单体蛋白,由约300~400个氨基酸残基组成,有一个由30-50个氨基酸组成的细胞外N-末端,接着在肽链中出现7个α螺旋的跨膜结构,每个疏水跨膜区段由20~25个氨基酸组成,但各区段之间由数目不等的氨基酸组成的环状结构连接,其中1-2,3-4,5-6环在胞内侧,2-3,4-5,6-7环在胞外侧,第7个跨膜螺旋是能够识别、即能结合某种特定外来化学信号的部位。C端氨基酸残基相差很大,位于胞内侧。比较大的5-6胞内侧环与C端都具有亲水性,它们是与G蛋白相互作用的区域。小分子配体是结合在受体跨膜部的疏水区域,多肽配体结合区既与跨膜部分有关也与胞外亲水环有关。
受体在结构上均为单体蛋白,由约300~400个氨基酸残基组成,有一个由30-50个氨基酸组成的细胞外N-末端,接着在肽链中出现7个α螺旋的跨膜结构,每个疏水跨膜区段由20~25个氨基酸组成,但各区段之间由数目不等的氨基酸组成的环状结构连接,其中1-2,3-4,5-6环在胞内侧,2-3,4-5,6-7环在胞外侧,第7个跨膜螺旋是能够识别、即能结合某种特定外来化学信号的部位。C端氨基酸残基相差很大,位于胞内侧。比较大的5-6胞内侧环与C端都具有亲水性,它们是与G蛋白相互作用的区域。小分子配体是结合在受体跨膜部的疏水区域,多肽配体结合区既与跨膜部分有关也与胞外亲水环有关。
G蛋白
三聚体GTP结合调节蛋白(trimeric GTP-binding regulatory protein)简称G蛋白,位于质膜胞质侧,由α、β、γ三个亚基组成,α 和γ亚基通过共价结合的脂肪酸链尾结合在膜上,G蛋白在信号转导过程中起着分子开关的作用,当α亚基与GDP结合时处于关闭状态,与GTP结合时处于开启状态,α亚基具有GTP酶活性,能催化所结合的ATP水解,恢复无活性的三聚体状态,其GTP酶的活性能被RGS(regulator of G protein signaling)增强。RGS也属于GAP(GTPase activating protein)。
种类:
参与细胞信息传递的G蛋白如下表:
| G蛋白类型 | α亚基 | 功能 |
| 刺激型G蛋白(Gs) | Gsα | 激活腺苷酸环化酶 |
| 抑制型G蛋白(Gi) | Giα | 抑制腺苷酸环化酶 |
| G蛋白(Gp) | | 激活磷脂酰肌醇特异的磷脂酶C |
| 转运蛋白(Gt) | Gtα | 激活鸟苷酸环化酶 |
| ras蛋白(p21) | 与α亚基单位同源 | 参与细胞增殖生长因子的激发 |
其它类型:
(1)化学感受器中的G蛋白
气味分子与化学感受器中的G蛋白偶联型受体结合,可激活腺苷酸环化酶,产生cAMP,开启cAMP门控阳离子通道(cAMP-gated cation channel),引起钠离子内流,膜去极化,产生神经冲动,最终形成嗅觉或味觉。
(2)视觉感受器中的G蛋白
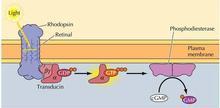
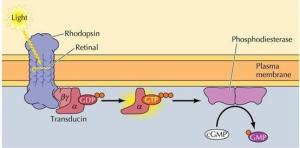
黑暗条件下视杆细胞(或视锥细胞)中cGMP浓度较高,cGMP门控钠离子通道开放,钠离子内流,引起膜去极化,突触持续向次级神经元释放递质。
视紫红质(rhodopsin, Rh)为7次跨膜蛋白,含一个11顺-视黄醛。是视觉感受器中的G蛋白偶联型受体,光照使Rh视黄醛的构象变为反式,Rh分解为视黄醛和视蛋白(opsin),构象改变的视蛋白激活G蛋白(transducin, Gt),G蛋白激活cGMP磷酸二酯酶,将细胞中的cGMP水解。从而关闭钠通道,引起细胞超极化,产生视觉。可见胞内cGMP水平下降的负效应信号起传递光刺激的作用。
视觉感受器的换能反映可表述为:
光信号→Rh激活→Gt活化→cGMP磷酸二酯酶激活→胞内cGMP减少→Na离子通道关闭→离子浓度下降→膜超极化→神经递质释放减少→视觉反应。
(3)小G蛋白
小G蛋白(Small G Protein)因分子量只有20~30KD而得名,同样具有GTP酶活性,在多种细胞反应中具有开关作用。第一个被发现的小G蛋白是Ras,它是ras基因[5]的产物。其它的还有Rho,SEC4,YPT1等,微管蛋白β亚基也是一种小G蛋白。
小G蛋白的共同特点是,当结合了GTP时即成为活化形式,这时可作用于下游分子使之活化,而当GTP水解成为GDP时(自身为GTP酶)则回复到非活化状态。这一点与Gα类似,但是小G蛋白的分子量明显低于Gα。
在细胞中存在着一些专门控制小G蛋白活性的小G蛋白调节因子,有的可以增强小G蛋白的活性,如鸟苷酸交换因子(guanine nucleotide exchange factor, GEF)和鸟苷酸解离抑制因子(Guanine nucleotide dissociation Inhibitor, GDI),有的可以降低小G蛋白活性,如GTP酶活化蛋白(GTPase activating protein, GAP)。
功能
| G蛋白类型 | α亚基 | 功能 |
| 刺激型G蛋白(Gs) | Gsα | 激活腺苷酸环化酶 |
| 抑制型G蛋白(Gi) | Giα | 抑制腺苷酸环化酶 |
| G蛋白(Gp) | | 激活磷脂酰肌醇特异的磷脂酶C |
| 转运蛋白(Gt) | Gtα | 激活鸟苷酸环化酶 |
| ras蛋白(p21) | 与α亚基单位同源 | 参与细胞增殖生长因子的激发 |
cAMP信号途径
G蛋白耦联型受体介导的信号转导可通过不同的通路产生不同的效应,但信号转导的基本模式大致相同,主要过程包括:
(1)配体与受体结合;
(2)受体活化G蛋白;
(3)G蛋白激活或抑制下游效应分子;
(4)效应分子改变细胞内第二信使的含量与分布;
(5)第二信使作用于相应的靶分子,使之构象改变,从而改变细胞的代谢过程及基因表达等功能。
由G蛋白耦联受体所介导的细胞信号通路主要包括:cAMP信号通路和磷脂酰肌醇信号通路。
 g蛋白耦联型受体图册(6) g蛋白耦联型受体图册(6) |
 g蛋白耦联型受体图册(6) g蛋白耦联型受体图册(6) |
磷脂酰肌醇途径
 g蛋白耦联型受体图册(6) g蛋白耦联型受体图册(6) |
 g蛋白耦联型受体图册(6) g蛋白耦联型受体图册(6) |
词条图册
在cAMP信号途径中,细胞外信号与相应受体结合,调节腺苷酸环化酶活性,通过第二信使cAMP水平的变化,将细胞外信号转变为细胞内信号。
(1)cAMP信号的组分
①激活型激素受体(Rs)或抑制型激素受体(Ri);
②活化型调节蛋白(Gs)或抑制型调节蛋白(Gi);
③腺苷酸环化酶(Adenylyl cyclase):是相对分子量为150KD的糖蛋白,跨膜12次。在Mg或Mn的存在下,腺苷酸环化酶催化ATP生成cAMP。
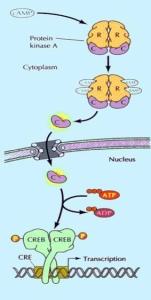
④蛋白激酶A(Protein Kinase A,PKA):由两个催化亚基和两个调节亚基组成,在没有cAMP时,以钝化复合体形式存在。cAMP与调节亚基结合,改变调节亚基构象,使调节亚基和催化亚基解离,释放出催化亚基。活化的蛋白激酶A催化亚基可使细胞内某些蛋白的丝氨酸或苏氨酸残基磷酸化,于是改变这些蛋白的活性,进一步影响到相关基因的表达。
⑤环腺苷酸磷酸二酯酶(cAMP phosphodiesterase):可降解cAMP生成5’-AMP,起终止信号的作用。
(2) Gs调节模型
 ①当细胞没有受到激素刺激,Gs处于非活化态,α亚基与GDP结合,此时腺苷酸环化酶没有活性;当激素配体与Rs结合后,导致Rs构象改变,暴露出与Gs结合的位点,使激素-受体复合物与Gs结合,Gs的α亚基构象改变,从而排斥GDP,结合GTP而活化,使三聚体Gs蛋白解离出α亚基和βγ基复合物,并暴露出α亚基与腺苷酸环化酶的结合位点;结合GTP的α亚基与腺苷酸环化酶结合,使之活化,并将ATP转化为cAMP。随着GTP的水解α亚基恢复原来的构象并导致与腺苷酸环化酶解离,终止腺苷酸环化酶的活化作用。α亚基与βγ亚基重新结合,使细胞回复到静止状态。
①当细胞没有受到激素刺激,Gs处于非活化态,α亚基与GDP结合,此时腺苷酸环化酶没有活性;当激素配体与Rs结合后,导致Rs构象改变,暴露出与Gs结合的位点,使激素-受体复合物与Gs结合,Gs的α亚基构象改变,从而排斥GDP,结合GTP而活化,使三聚体Gs蛋白解离出α亚基和βγ基复合物,并暴露出α亚基与腺苷酸环化酶的结合位点;结合GTP的α亚基与腺苷酸环化酶结合,使之活化,并将ATP转化为cAMP。随着GTP的水解α亚基恢复原来的构象并导致与腺苷酸环化酶解离,终止腺苷酸环化酶的活化作用。α亚基与βγ亚基重新结合,使细胞回复到静止状态。
②活化的βγ亚基复合物也可直接激活胞内靶分子,具有传递信号的功能,如心肌细胞中G蛋白耦联受体在结合乙酰胆碱刺激下,活化的βγ亚基复合物能开启质膜上的K通道,改变心肌细胞的膜电位。此外βγ亚基复合物也能与膜上的效应酶结合,对结合GTP的α亚基起协同作用或拮抗作用。
③霍乱毒素能催化ADP核糖基共价结合到Gs的α亚基上,致使α亚基丧失GTP酶的活性,结果GTP永久结合在Gs的α亚基上,使α亚基处于持续活化状态,腺苷酸环化酶永久性活化。导致霍乱病患者细胞内Na和水持续外流,产生严重腹泻而脱水。
该信号途径涉及的反应链可表示为:
激素→G蛋白耦联受体→G蛋白→腺苷酸环化酶→cAMP→依赖cAMP的蛋白激酶A→基因调控蛋白→基因转录。
不同细胞对cAMP信号途径的反应速度不同,在肌肉细胞1秒钟之内可启动糖原降解为葡糖-1-磷酸,而抑制糖原的合成。在某些分泌细胞,需要几个小时,激活的PKA 进入细胞核,将CRE结合蛋白磷酸化,调节相关基因的表达。CRE(cAMP response element )是DNA上的调节区域。
(3)Gi调节模型
Gi对腺苷酸环化酶的抑制作用可通过两个途径:
①通过α亚基与腺苷酸环化酶结合,直接抑制酶的活性;
②通过βγ亚基复合物与游离Gs的α亚基结合,阻断Gs的α亚基对腺苷酸环化酶的活化。
百日咳毒素催化Gi的α亚基ADP-核糖基化,结果降低了GTP与Gi的α亚基结合的水平,使Gi的α亚基不能活化,从而阻断了Ri受体对腺苷酸环化酶的抑制作用,但尚不能解释百日咳症状与这种作用机理有关。

-
新款斯巴鲁BRZ上市 雪佛兰开拓者将推5款车型
2025-09-22 21:18:31 查看详情 -
全新紧凑型SUV/上半年上市 别克昂科拉PLUS最新谍照
2025-09-22 21:18:31 查看详情 -
江铃福特轻客持续打造最优TCO 江铃E200N豪华型怎么样
2025-09-22 21:18:31 查看详情 -
380TSI劲擎智联版四驱车型上市 成都车展:雪铁龙C
2025-09-22 21:18:31 查看详情 -
将于1月6日上市 450六座版车型上市
2025-09-22 21:18:31 查看详情 -
捷途X95热爱Pro版上市 别克微蓝6插混车型上市
2025-09-22 21:18:31 查看详情 -
欧拉闪电猫将于10月31日上市 新增1.5T车型
2025-09-22 21:18:31 查看详情 -
25T车型上市 预售价17.77
2025-09-22 21:18:31 查看详情 -
凯迪拉克CT6新车型上市 W帅气亮相
2025-09-22 21:18:31 查看详情 -
POWER版车型上市 油耗1.7L/100km
2025-09-22 21:18:31 查看详情


 求购
求购

