- 三氧化二氢

三氧化二氢
简介
 H2O3
H2O3
上述反应的逆反应(向水分子中插入单线态氧原子)一般情况下由于单线态氧原子不足而速率小于正反应速率。
理论研究表明,有顺式和反式共两种异构体,其中反式异构体比顺式异构体更稳定。二阶全活化空间微扰理论(complete active space perturbation theory of second order,CASPT2)预测结果显示,在单激发态中,顺式三氧化二氢寿命最长的激发态为21A",跃迁能为167.43nm,寿命为1.44×10∧-5s;而反式三氧化二氢寿命最长的激发态为21A,其跃迁能为165.52nm,寿命为2.07×10∧-5s。
也就是说,这种物质极易分解,即使是刚制备好的三氧化二氢,没多久就消失在水中了。
制备
三氧化二氢可由O₃和H2O2的反应或水的电解少量制备。用以上两种反应制得的过H₂O₃的量虽然较少,但已可检测出其存在。
若需获得大量H₂O₃,则要利用有机还原剂(例如氢化偶氮苯)在有机溶剂中低温还原O₃,H₂O₃也能在有机过三氧化氢分解时产生(ROOOH)。
O₃与H₂O₂反应(过臭氧化)的过程也被称为“过臭氧过程”(Peroxone process)。而O₃与H₂O₂的混合物曾被用作含有各种有机化合物的地下水的处理剂。上述反应也能产生H2O5及一些环状化合物。
结构
光谱学分析已指出三氧化二氢分子具有曲折的结构(H-O-O-O-H),具有C2对称性,其中,H₂O₃O-O键的键长约为142.8pm,略短于H2O3中的146.4pm。O-H键的键长为96.6pm,H-O-O键角为101.9°,O-O-O键角为106.8°,H-O-O-O二面角为81.2°。
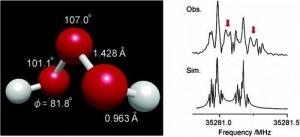 三氧化二氢结构H₂O₃还可能以多种二聚体及三聚体的形式存在。
三氧化二氢结构H₂O₃还可能以多种二聚体及三聚体的形式存在。
酸性
H₂O₃是一种弱电解质,其酸性比H₂O₂略强,在溶液中可电离产生H+和OOOH-。
反应
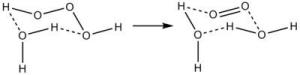 三氧化二氢的分解其能自发地分解为水与单线态氧。室温下有机溶剂中的H₂O₃的半衰期约为16min,而H₂O₃在水中的半衰期只有几毫秒。
三氧化二氢的分解其能自发地分解为水与单线态氧。室温下有机溶剂中的H₂O₃的半衰期约为16min,而H₂O₃在水中的半衰期只有几毫秒。
三氧化二氢能与有机硫化物反应生成亚砜,但现在对这类反应的了解仍不多。
存在形式
由于在生命系统中H₂O₃像臭氧/过氧化氢混合物一样,也能由人体内的抗体能产生,并利用其强氧化性对抗入侵的细菌等病原体。所以新近的研究认为H₂O₃是上述混合物中起抗菌作用的活性物质。生命系统中H₂O₃由免疫细胞产生的单线态氧和水反应获得(该化学反应的方向视各物质的浓度而定)。
2005年,H₂O₃被利用微波光谱学在超音速客机中发现,其分子呈现反式构象(trans conformation),其中的O-O键短于H₂O₂中的O-O键。
计算化学方面的预测表明还可能有包含更多氧原子的链状分子(或过多氧化氢)存在,在低温气体中,甚至连具有无数个氧原子的链也可能存在。
在该证据支持下,一项对星际物质中的这类物质的寻找可能将会展开。

-
一汽丰田柯斯达氢擎实车曝光 陆放实车曝光
2025-09-27 21:42:14 查看详情 -
一汽 一汽丰田柯斯达氢擎实车曝光
2025-09-27 21:42:14 查看详情 -
一汽丰田全新车型预告图曝光 定位氢燃料客车
2025-09-27 21:42:14 查看详情 -
一汽奔腾B70S正式上市 定位氢燃料客车
2025-09-27 21:42:14 查看详情 -
一汽丰田柯斯达氢擎实车曝光 运动版将于4月底上市
2025-09-27 21:42:14 查看详情 -
一汽丰田威驰20周年纪念版今日上市 定位氢燃料客车
2025-09-27 21:42:14 查看详情 -
一汽丰田柯斯达氢擎实车曝光 大众新技术开发中心落成使用
2025-09-27 21:42:14 查看详情


 求购
求购



