- 赫斯定律

赫斯定律
定律表述
赫斯定律定义:一个反应,在定压或定容条件下,不论是一步完成还是分几步完成,其反应热是相同的,总反应方程式的焓变等于各部分分步反应按一定系数比加和的焓变。赫斯定律换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,而这可以看出,赫斯定律实际上是“内能和焓是状态函数”这一结论的进一步体现。[1]
推导过程
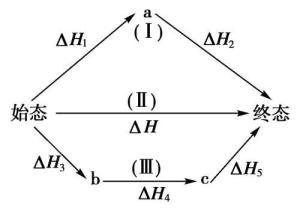 当反应体系不做非体积功,Qp=ΔH,Qv=ΔU,而H和U都是状态函数,当反应的初始状态和终止状态一定时,H和U的改变值ΔH和ΔU与途径无关。所以无论是一步完成反应,或是多步完成反应,反应是否有中间步骤或有无催化剂介入等,均对Qv或Qp数值没有影响,其反应热都一样。
当反应体系不做非体积功,Qp=ΔH,Qv=ΔU,而H和U都是状态函数,当反应的初始状态和终止状态一定时,H和U的改变值ΔH和ΔU与途径无关。所以无论是一步完成反应,或是多步完成反应,反应是否有中间步骤或有无催化剂介入等,均对Qv或Qp数值没有影响,其反应热都一样。
适用范围
适用于任何状态函数,但使用该定律要注意:
1、赫斯定律只适用于等温等压或等温等容过程,各步反应的温度应相同;
2、参与反应的各物质的本性、聚集状态、完成反应的物质数量,反应进行的条件方式、温度、压力等因素均一致。
3、各步反应均不做非体积功。
4、若有很多数据,选择最短的途径。以致计算方便误差小。[2]
实际应用
有些反应的反应热通过实验测定有困难(有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯、有副反应发生),可以用赫斯定律间接计算出来。
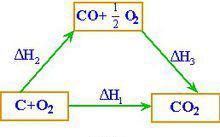 例 求反应C(s)+ 1/2 O2(g)→CO(g)的反应热ΔH解:已知 (I) C(s)+ O2(g)==CO2(g) ΔHΘm= - 393.5 kJ/moI
例 求反应C(s)+ 1/2 O2(g)→CO(g)的反应热ΔH解:已知 (I) C(s)+ O2(g)==CO2(g) ΔHΘm= - 393.5 kJ/moI
(II)CO(g)+ 1/2 O2(g)==CO2(g) ΔHΘm= - 282.0 kJ/mol
由(I)-(II)式得 C(s)+ 1/2 O2(g)== CO(g)
ΔH = ΔH(I)- ΔH (II)
= - 393.5 -( - 282.0)= -110.5 kJ/mol
C和O2的反应不可能控制在CO而无CO2生成的程度,因此无法通过实验测定这样反应的反应热。然而根据赫斯定律,利用C和CO的燃烧热,很容易计算生成CO反应的焓变。
定律影响
尽管赫斯定律出现在热力学第一定律提出前的经验定律,但亦可通过热力学第一定律推导出。赫斯定律的建立,使得热化学反应方程式可以向普通代数方程式一样进行计算,有很大的实用性。



 求购
求购










