- 价电子对数

价电子对数
互斥理论
 ——一种快速判断分子和离子构型的方法
——一种快速判断分子和离子构型的方法
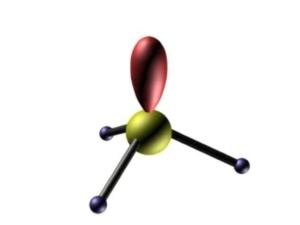
分子中的价电子对(包括成键电子对n,和孤电子对m)由于相互排斥作用,尽可能趋向彼此远离以减小斥力。
【注意】如果分子中存在孤对电子对,由于孤对电子对比成键电子对更靠近原子核,它对相邻成键电子对的排斥作用较大,因而使相应的键角变小。
价电子对数计算
(1)价电子对数=成键电子对n + 孤电子对m
(2)成键电子对n=与中心原子成键的原子个数
(3)孤电子对m=(中心原子价电子数-与中心原子结合的原子未成对电子数和)/2
(4)阳离子在分子上减去所带电荷数 阴离子在分子上加上所带电荷数
价电子对数与杂化轨道空间构型关系
2 |
3 | 4 | 5 | 6 | |
| 杂化轨道空间构型 | 直线形 | 平面三角形 | 正四面体 | 三角双锥 | 正八面体 |
 分子空间构型(5)
分子空间构型(5)
推断分子空间构型的具体步骤
⑴、先确定中心原子的价层电子对数,再确定杂化轨道的空间构型
n=2 直线形
n=3 平面三角形
n=4正四面体
⑵、确定中心原子的孤对电子对数,推断分子的空间构型。
① 若孤电子对数为0,则分子的空间构型和杂化轨道的空间构型相同
② 若孤电子对数不为0,则分子的空间构型和杂化轨道的空间构型不同。
| 分子 | CO2 | BeCl2 | BF3 | CH4 | HeO2 | NH3 |
| 价电子对数 | 2 | 2 | 3 | 4 | 4 | 4 |
| 杂化轨道构型 | 直线形 | 直线形 | 正三角形 | 正四面体 | 正四面体 | 正四面体 |
| 有无孤对电子 | 无 | 无 | 无 | 无 | 有 | 有 |
| 分子空间结构 | 直线形 | 直线形 | 平面三角形 | 正四面体 | V形 | 三角锥形 |
推断离子空间构型的方法
方法同分子空间构型的确定。区别在于算中心原子价电子对数时,正离子应减去电荷数,负离子应加上电荷数。
空间构型
2 |
3 | 4 | 5 | 6 | |
| 杂化轨道空间构型 | 直线形 | 平面三角形 | 正四面体 | 三角双锥 | 正八面体 |
等电子原理
| 分子 | CO2 | BeCl2 | BF3 | CH4 | HeO2 | NH3 |
| 价电子对数 | 2 | 2 | 3 | 4 | 4 | 4 |
| 杂化轨道构型 | 直线形 | 直线形 | 正三角形 | 正四面体 | 正四面体 | 正四面体 |
| 有无孤对电子 | 无 | 无 | 无 | 无 | 有 | 有 |
| 分子空间结构 | 直线形 | 直线形 | 平面三角形 | 正四面体 | V形 | 三角锥形 |
词条图册
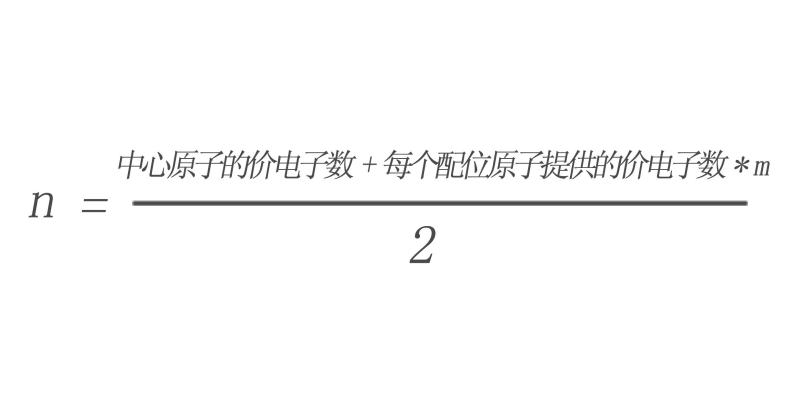
对于ABm型分子(A是中心原子,B是配位原子),分子中的价电子对数可以用下式计算:
 公式图
公式图
n=(中心原子的价电子数+每个配位原子提供的价电子数×m)/2
价电子对数目为2、3、4时,价电子对的几何分布分别呈直线形、平面三角形、正四面体构型。
注意:
①中心原子的价电子数等于中心原子的最外层电子数。
②配位原子中卤素原子、氢原子提供一个价电子,氧原子和硫原子按不提供价电子计算,但做为中心原子时提供6个价电子。
③若讨论的是离子,应加上或减去离子的电荷数。(阳离子应减去电荷数,阴离子应加上电荷数。)
杂化类型与轨道空间构型及分子构型的关系
| 杂化类型 | 杂化类型 | 杂化轨道空间构型 | 分子空间构型 |
| sp杂化 | SP | 直线形 | 直线形 |
| sp2杂化 | SP2 | 平面正三角形 | 平面三角形V形 |
| sp3杂化 | SP3 | 正四面体形 | 正四面体形三角锥形V形 |
小结:
对于ABm型分子,若价电子对数与配位原子数目相等,则分子的空间构型与杂化轨道的空间构型相同。
若价电子对数与配位原子数目不等,则中心原子的孤电子对影响分子的空间构型。
含碳原子轨道杂化方式的判断
看中心原子有没有形成双键或叁键,如果有1个叁键,则其中有2个π键,用去了2个p轨道,形成的是sp杂化;如果有1个双键则其中有1个π键,形成的是sp2杂化;如果全部是单键,则形成的是sp3杂化。即:每个碳原子的杂化轨道数=碳原子所成的σ键数。

-
华中科技大学光学与电子信息学院
2025-11-02 10:18:44 查看详情 -
电子科技大学(沙河校区)
2025-11-02 10:18:44 查看详情 -
Jin Air Green Wings电子竞技俱乐部
2025-11-02 10:18:44 查看详情 -
杭州电子信息职业学校
2025-11-02 10:18:44 查看详情 -
云南师范大学物理与电子信息学院
2025-11-02 10:18:44 查看详情


 求购
求购









