- 三氧化氙

三氧化氙
化学性质
高于40℃分解。吸湿能力很强。易爆炸,在潮湿空气中爆炸力很强。在水中主要以分子形式存在,但在碱性溶液中主要以HXeO 存在,与XeO 分子相比,HXeO 分解的速度要快得多: 2 HXeO → 2 Xe +3 O + 2 OH ,因此三氧化氙会以HXeO 的形式迅速分解
强碱浓度大于0.1mol/L时,三氧化氙会按下式歧化: 2 HXeO + 2 OH → XeO + Xe +O + 2 H O 碱的浓度越高,歧化速度越快,因而在碱的浓度较高时XeO 的产率可达到50%
三氧化氙是非常强的 氧化剂。可以将Cl 氧化成Cl ,I 氧化为I ,Mn 氧化为MnO 甚至MnO ,还能将 醇或 羧酸氧化为H O和O 。用已知量的XeO 氧化有机物为CO 和H O,然后用碘量法滴定剩余的XeO ,便可准确地测出有机物的含量。特别是对于那些难于氧化的羧酸(如 乙酸、 琥珀酸),XeO 氧化法更显示出优越性。XeO 的还原产物为 氙,几乎不给体系带来杂质。
可由 氟化氙水解制得。用作 氧化剂。也可作为高氙酸盐的制备原料。
结构
分子结构:Xe原子以sp3杂化轨道成键,XeO 分子为三角锥形分子。
晶体结构:斜方晶系;a = 616.3pm,b = 811.5pm,c = 523.4pm;每个单元包含4个XeO 分子。
制备
用 六氟化氙水解生成三氧化氙是传统的制备方法,有时也用 四氟化氙水解歧化来制取三氧化氙,但这两个反应都进行得很剧烈,并容易发生爆炸,下述的制备方法较安全。
制备三氧化氙的实验装置如图所示,此装置同时也用来制备高氙酸钠。
A—Pyrex玻璃筒;B—主反应瓶;C—球形烧瓶;D—连接管;E—烧瓶底部小孔;F—三通;G—储存管;H—U形冷阱
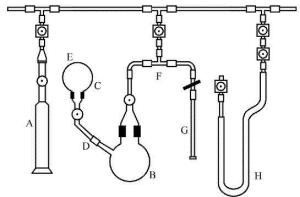 图中A为储存二氟磷酸的有刻度的Pyrex玻璃筒,此玻璃筒用一玻璃阀门与系统相连,一个倒置的球形烧瓶C用一个3/8英寸的连接管D连接到主反应瓶B上,在倒置的烧瓶C的底部有一孔E,在制备高氙酸钠时可以从这里引入NaOH溶液。XeF 从储存管G中通过一个聚三氟氯乙烯的T形连接管输送到主反应器中,安装在装置上的聚 三氟氯乙烯的U形冷阱H可以很容易的与XeF 储存管G相互替换。
图中A为储存二氟磷酸的有刻度的Pyrex玻璃筒,此玻璃筒用一玻璃阀门与系统相连,一个倒置的球形烧瓶C用一个3/8英寸的连接管D连接到主反应瓶B上,在倒置的烧瓶C的底部有一孔E,在制备高氙酸钠时可以从这里引入NaOH溶液。XeF 从储存管G中通过一个聚三氟氯乙烯的T形连接管输送到主反应器中,安装在装置上的聚 三氟氯乙烯的U形冷阱H可以很容易的与XeF 储存管G相互替换。
150mL的反应瓶B加热干燥并抽空,通过真空系统使0.83g XeF 从储存管G中转移到反应瓶中,并用液氮使其冷却到-195℃,在瓶底形成一个直径约3cm固体片,转移完后关闭反应瓶与真空系统的隔离阀,取下储存管G换上U形冷阱H。打开反应瓶及HOPOF 储存筒A与真空系统的隔离阀,使约1.2mL HOPOF 冷凝在XeF 之上,然后将HOPOF 储存筒A从系统中拆除,以减小万一发生爆燃所造成的损失。将反应瓶直接升温到22℃,XeF 溶于HOPOF 而形成黄绿色的溶液。用0℃的冷浴冷却反应瓶,而U形冷阱则用液氮冷却至-195℃。在大约0℃时,反应瓶中开始强烈鼓泡,几乎瞬间即沉淀出白色的XeO 结晶。慢慢将剩余的HOPOF 、HF和POF 抽出,直至没有明显的气体挥发出来为止。反应瓶中留下的结晶即为XeO 产品。

-
氧化锌避雷器带电测试仪
2025-09-21 04:17:55 查看详情 -
氧化锌避雷器特性测试仪
2025-09-21 04:17:55 查看详情 -
二氧化碳气体保护焊机
2025-09-21 04:17:55 查看详情 -
汽车二氧化锆式氧传感器
2025-09-21 04:17:55 查看详情


 求购
求购







