- 氧气

氧气
研究简史
发现历史
 约瑟夫·普里斯特利普利斯特里对氧气的研究
约瑟夫·普里斯特利普利斯特里对氧气的研究
普利斯特里从布莱克煅烧石灰石对CO2的发现受到启发,利用凸透镜聚集太阳光使一些物质燃烧或分解放出气体并进行研究。1774年8月1日,普利斯特里终于成功地制得了氧气,成为化学史上有重大意义的事件。
他的实验非常简单,把氧化汞放在一个充满水银的玻璃瓶里,然后,把玻璃瓶倒放在水银槽中,玻璃瓶完全被水银充满,空气全被排除掉,氧化汞浮在最上面。然后,他用凸透镜聚集太阳光,照射到氧化汞上,使氧化汞受热。
经过长期加热,温度逐渐升高,氧化汞受热分解成汞,并放出氧气。于是,氧气聚集起来排走玻璃瓶中的汞,使汞面降低。气体空间体积不断增加,直到气体体积为氧化汞体积的三四倍为止。其反应方程式为: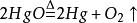 。
。
但是,当初他并不知道制得的纯净气体是氧气。尽管如此,细心的普利斯特里又做了许多试验来了解这种气体的性质,以及它同别种“空气”的区别。他的研究方法是:
- 他将研究的气体放在玻璃瓶中,倒一些水进去,该气体不溶解。
- 他把燃烧的蜡烛放进该气体中,蜡烛竟放出耀眼的强光。
- 他把一只老鼠放到充满该气体的瓶子里,老鼠活蹦乱跳,很自在,他猜想人吸入了可能也好受。
- 他用玻璃管把大瓶中的氧气吸入肺中,并记下自己的感觉:“我觉得十分愉快,我肺部的感觉好像和平常呼吸空气一样,没有什么不适。而且,吸进这种气体后,好久好久,身体还是十分轻松愉快。也许,有一天,谁能断定这种气体不会变成时髦的奢侈品呢?不过。现在,世界上能够享受这种气体的愉快,只有两只老鼠和我自己。”
普氏从上述实验中得出,该气体有助燃、助呼吸作用,这些性质与一般空气类似,但作用更强。但是,他把氧气所这种新气体错误地用燃素说来解释,并把制得的氧气称为“脱燃素空气”。由于运用了错误的理论,这种命名是不恰当的。
 卡尔·威廉·舍勒舍勒对氧气的发现
卡尔·威廉·舍勒舍勒对氧气的发现
1772年,舍勒对空气进行研究后,他首先认识到氧气是空气的一种重要成分。他用硫磺和铁粉混合,在空气中燃烧,消耗掉钟罩中空气中的氧气而制得氮气,当时他称它为“浊气”或“用过的空气”,或能使人死亡的气体。
经过思索,舍勒明白了,原来当时人们认为空气是一种元素的观点是错误的。他猜想:空气是两种不同物质的混合,一种是浊气,能使人死亡的空气;一种是能使人活命的空气,能帮助燃烧,在燃烧中消失。于是,舍勒产生了兴趣,并开始了他的实验。
1773年,他把硝石(KNO3)装进曲颈瓶,瓶口系一个排完空气的猪膀胱,再把曲颈瓶放到火炉上去烧。硝石融化时分解,放出一种气体,很快把猪膀胱充满了,这种气体正是那种能活命的气体,即现在所知道的氧气。
舍勒进行了仔细的鉴别,他把红热的木炭扔到充满“能活命的气体”的瓶中,木炭迅速燃烧,光亮耀眼,比在普通空气中燃烧得更快更亮。舍勒将1/5的这种气体和4/5浊气混合于瓶中,蜡烛能正常燃烧,老鼠也同在普通空气中一样呼吸。由此他确定这种气体是一种纯净的能活命的气体。
舍勒给这种气体命名为“火空气”,因为他发现除硝石外,加热氧化汞、高锰酸钾、碳酸银、碳酸汞,均能释放出氧气来。
 拉瓦锡拉瓦锡对氧气的研究
拉瓦锡拉瓦锡对氧气的研究
拉瓦锡对氧气的发现是在普里斯特里启发下完成的。1774年,拉瓦锡用汞灰(HgO)的合成与分解实验制得氧气,并对它进行了系统的研究,发现它能与很多非金属单质合成多种酸,故命名为“酸气”(希腊文Oxygene)。
拉瓦锡通过氧气的实验,提出了燃烧的氧化学说,推翻了燃素说,发动了化学史上著名的化学革命,使过去以燃素说形式倒立着的化学正立过来。因此,虽然不是他首先发现氧气,但恩格斯还是称他为“真正发现氧气的人”,而舍勒和普利斯特里是“当真理碰到鼻尖上的时候还是没有得到真理”。
中国马和对氧气的发现
1802年,德国东方学者克拉普罗特偶然读到一本64页的汉文手抄本,书名是《平龙认》,作者是马和,著作年代是唐代至德元年(公元756年)。克拉普罗特读完此书以后,惊奇地发现,这本讲述如何在大地上寻找“龙脉”的堪舆家著作,竟揭示了深刻的科学道理:空气和水里都有氧气存在。
1807年,克拉普罗特在彼得堡俄国科学院学术讨论会上宣读了一篇论文,题目是《第八世纪中国人的化学知识》,其中提到,空气中存在“阴阳二气”,用火硝、青石等物质加热后就能产生“阴气”;水中也有“阴气”,它和“阳气”紧密结合在一起,很难分解。克拉普罗特指出,马和所说的“阴气”,就是氧气。证明中国早在唐朝就知道氧气的存在并且能够分解它,比欧洲人发现氧气足足早了1000多年。克拉普罗特这篇论文使在场的科学家都感到惊奇不已。[4]
名称由来
氧气(Oxygen)希腊文的意思是“酸素”,该名称是由法国化学家拉瓦锡所起,原因是拉瓦锡错误地认为,所有的酸都含有这种新气体。日文里氧气的名称仍然是“酸素”。
氧气的中文名称是清朝徐寿命名的。他认为人的生存离不开氧气,所以就命名为“养气”即“养气之质”,后来为了统一就用“氧”代替了“养”字,便叫这“氧气”。
分子结构
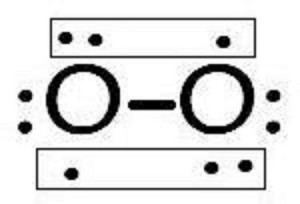 氧气的结构O2分子内的化学键通常是共价键。
氧气的结构O2分子内的化学键通常是共价键。
从实验上来说,顺磁共振光谱证明O有顺磁性,还证明O有两个未成对地电子。说明原来的以双键结合的氧分子结构式不符合实际。
氧气的结构如右图所示,基态O2分子中并不存在双键,氧分子里形成了两个三电子键。
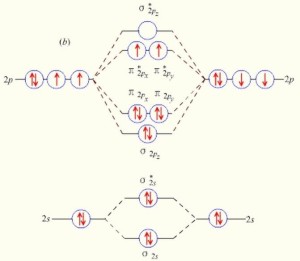 氧气分子的分子轨道能级图氧的分子轨道电子排布式是
氧气分子的分子轨道能级图氧的分子轨道电子排布式是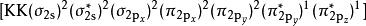 ,在π轨道中有不成对的单电子,所以O2分子是所有双原子气体分子中唯一的一种具有偶数电子同时又显示顺磁性的物质。[5]
,在π轨道中有不成对的单电子,所以O2分子是所有双原子气体分子中唯一的一种具有偶数电子同时又显示顺磁性的物质。[5]
两个氧原子进行sp轨道杂化,一个单电子填充进sp杂化轨道,成σ键,另一个单电子填充进p轨道,成π键。氧气是奇电子分子,具有顺磁性。[5]
单线态氧和三线态氧
普通氧气含有两个未配对的电子,等同于一个双游离基。两个未配对电子的自旋状态相同,自旋量子数之和S=1,2S+1=3,因而基态的氧分子自旋多重性为3,称为三线态氧。
在受激发下,氧气分子的两个未配对电子发生配对,自旋量子数的代数和S=0,2S+1=1,称为单线态氧。
空气中的氧气绝大多数为三线态氧。紫外线的照射及一些有机分子对氧气的能量传递是形成单线态氧的主要原因。单线态氧的氧化能力高于三线态氧。
单线态氧的分子类似烯烃分子,因而可以和双烯发生狄尔斯-阿尔德反应。
物化性质
物理性质
 氧气瓶无色无味气体,熔点-218.8℃,沸点-183.1℃,相对密度1.14(-183℃,水=1),相对蒸气密度1.43(空气=1),饱和蒸气压506.62kPa(-164℃),临界温度-118.95℃,临界压力5.08MPa,辛醇/水分配系数:0.65。[2]大气中体积分数:20.95%(约21%)。
氧气瓶无色无味气体,熔点-218.8℃,沸点-183.1℃,相对密度1.14(-183℃,水=1),相对蒸气密度1.43(空气=1),饱和蒸气压506.62kPa(-164℃),临界温度-118.95℃,临界压力5.08MPa,辛醇/水分配系数:0.65。[2]大气中体积分数:20.95%(约21%)。
同素异形体:臭氧(O3),四聚氧(O4),红氧(O8)。
| 性质 | 条件或符号 | 单位 | 数据 |
| 气体密度 | 克/立方厘米 | 0.001331 | |
| 液体密度 | 千克/升 | 1.141 | |
| 气体比重 | 空气=1 | 1.105 | |
| 摩尔体积 | 标准状况 | 升/摩尔 | 22.39 |
| 溶解热 | 千焦/摩尔 | 0.44 | |
| 气化热 | 千焦/摩尔 | 6.82 | |
| 介电常数 | 20℃,1大气压 | 1.0004947+2 | |
| 液氧介电常数 | -193℃ | 1.507 | |
| 折射系数 | 0℃,1大气压 | 1.000271 | |
| 磁感性 | 20℃ | 立方厘米/克 | 106.2 |
| 迁移率 | 正离子 负离子 | 平方厘米/伏.秒 平方厘米伏.秒 | 1.32 1.83 |
| 扩散系数(同种气体中) | 0℃,133.3Pa 正离子 负离子 | 平方厘米/伏.秒 平方厘米/伏.秒 | 21.3 32.0 |
| 在水中的分子扩散系数 | 20℃ | 平方厘米/伏.时 | 6.7×10-2 |
| 电离能 | 氧分子 | 千焦/摩尔 | 1165.9 |
表格参考资料来源:高纯气体
化学性质
| 性质 | 条件或符号 | 单位 | 数据 |
| 气体密度 | 克/立方厘米 | 0.001331 | |
| 液体密度 | 千克/升 | 1.141 | |
| 气体比重 | 空气=1 | 1.105 | |
| 摩尔体积 | 标准状况 | 升/摩尔 | 22.39 |
| 溶解热 | 千焦/摩尔 | 0.44 | |
| 气化热 | 千焦/摩尔 | 6.82 | |
| 介电常数 | 20℃,1大气压 | 1.0004947+2 | |
| 液氧介电常数 | -193℃ | 1.507 | |
| 折射系数 | 0℃,1大气压 | 1.000271 | |
| 磁感性 | 20℃ | 立方厘米/克 | 106.2 |
| 迁移率 | 正离子 负离子 | 平方厘米/伏.秒 平方厘米伏.秒 | 1.32 1.83 |
| 扩散系数(同种气体中) | 0℃,133.3Pa 正离子 负离子 | 平方厘米/伏.秒 平方厘米/伏.秒 | 21.3 32.0 |
| 在水中的分子扩散系数 | 20℃ | 平方厘米/伏.时 | 6.7×10-2 |
| 电离能 | 氧分子 | 千焦/摩尔 | 1165.9 |
制取方法
 氧气氧气的化学性质比较活泼。除了稀有气体、活性小的金属元素如金、铂、银之外,大部分的元素都能与氧气反应,这些反应称为氧化反应,而经过反应产生的化合物(有两种元素构成,且一种元素为氧元素)称为氧化物。一般而言,非金属氧化物的水溶液呈酸性,而碱金属或碱土金属氧化物则为碱性。此外,几乎所有的有机化合物,可在氧中剧烈燃生成二氧化碳与水。化学上曾将物质与氧气发生的化学反应定义为氧化反应,氧化还原反应指发生电子转移或偏移的反应。氧气具有助燃性,氧化性。[5]
氧气氧气的化学性质比较活泼。除了稀有气体、活性小的金属元素如金、铂、银之外,大部分的元素都能与氧气反应,这些反应称为氧化反应,而经过反应产生的化合物(有两种元素构成,且一种元素为氧元素)称为氧化物。一般而言,非金属氧化物的水溶液呈酸性,而碱金属或碱土金属氧化物则为碱性。此外,几乎所有的有机化合物,可在氧中剧烈燃生成二氧化碳与水。化学上曾将物质与氧气发生的化学反应定义为氧化反应,氧化还原反应指发生电子转移或偏移的反应。氧气具有助燃性,氧化性。[5]
| 化学方程式 | 现象 | |
|---|---|---|
| 与钾的反应 | 4K+O2=2K2O | 钾的表面变暗 |
| 2K+O2=K2O2 | ||
| K+O2=KO2(超氧化钾) | ||
| 与钠的反应 | 4Na+O2=2Na2O | 钠的表面变暗 |
| 产生黄色火焰,放出大量的热,生成淡黄色粉末 | ||
| 与镁的反应 | 2Mg+O2=点燃=2MgO | 剧烈燃烧发出耀眼的强光,放出大量热,生成白色粉末状固体。 |
| 与铝的反应 | 4Al+3O2=点燃=2Al2O3 | 发出明亮的光,放出热量,生成白色固体。 |
| 与铁的反应 | 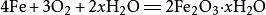 (铁锈的形成) (铁锈的形成) |
|
| 3Fe+2O2=点燃=Fe3O4 | 红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。 铁丝在充满氧气的集气瓶中燃烧 铁丝在充满氧气的集气瓶中燃烧 |
|
| 与锌的反应 | 2Zn+O2=点燃=2ZnO | |
| 与铜的反应 | 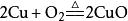 |
加热后亮红色的铜丝表面生成一层黑色物质。 |
| 化学方程式 | 现象 | |
|---|---|---|
| 与氢气的反应 | 2H2+O2=点燃=2H2O | 安静地燃烧,产生淡蓝色的火焰,生成水并放出大量的热。[6] |
| 与碳的反应 | C+O2=点燃=CO2 | 剧烈燃烧,发出白光,放出热量,生成使澄清石灰水变浑浊的气体。 |
| 2C+O2=点燃=2CO (氧气不充足时) | ||
| 与硫的反应 | S+O2=点燃=SO2 | 在空气中燃烧,发出微弱的淡蓝色火焰;在纯氧中燃烧得更旺,发出蓝紫色火焰,放出热量,生成有刺激性气味的气体[7]。该气体能使澄清石灰水变浑浊,且能使酸性高锰酸钾溶液或品红溶液褪色,褪色的品红溶液加热后颜色又恢复为红色。 硫在氧气中燃烧 硫在氧气中燃烧 |
| 与红磷的反应 | 4P+5O2=点燃=2P2O5 | 发出耀眼白光,放热,生成大量白烟。 |
| 与白磷的反应 | 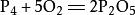 |
白磷在空气中自燃,发光发热,生成白烟。 |
| 与氮气的反应 | N2+O2=高温或放电=2NO |
| 如甲烷、乙炔、酒精、石蜡等能在氧气中燃烧生成水和二氧化碳。气态烃类的燃烧通常发出明亮的蓝色火焰,放出大量的热,生成水和能使澄清石灰水变浑浊的气体。 | ||
| 甲烷 | CH4+2O2=点燃=CO2+2H2O | |
| 乙烯 | C2H4+3O2=点燃=2CO2+2H2O | |
| 乙炔 | 2C2H2+5O2=点燃=4CO2+2H2O | |
| 苯 | 2C6H6+15O2=点燃=12CO2+6H2O | 在空气中燃烧时,火焰明亮并有浓黑烟。 |
| 甲醇 | 2CH3OH+3O2=点燃=2CO2+4H2O | |
| 乙醇 | CH3CH2OH+3O2=点燃=2CO2+3H2O | |
| 烃的燃烧通式 | 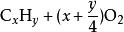 =点燃=xCO2+2yH2O(通式完成后应注意化简!下同) =点燃=xCO2+2yH2O(通式完成后应注意化简!下同) |
|
| 碳氢氧化合物与氧气发生燃烧的通式 | 4CxHyOz+(4x+y-2z)O2=点燃=4xCO2+2yH2O | |
| 乙醇被氧气氧化 | ||
| 氯仿与氧气的反应 | 2CHCl3+O2=2COCl2(光气)+2HCl | |
| 硫化氢的燃烧 | 2H2S+3O2(过量)=点燃=2H2O+2SO2[8]2H2S+O2(少量)=点燃=2H2O+2S[8] |
| 煅烧黄铁矿 | 4FeS2+11O2=高温=2Fe2O3+8SO2 |
| 二氧化硫的催化氧化 | 2SO2+O2←催化剂,△→2SO3 |
| 空气中硫酸酸雨的形成 | 2SO2+O2+2H2O=2H2SO4 |
| 氨在纯氧中的燃烧 | 4NH3+3O2(纯)=点燃=2N2+6H2O |
| 氨的催化氧化 | |
| 一氧化氮与氧气的反应 | 2NO+O2=2NO2 |
| 转化为臭氧的反应 | 3O2=放电=2O3(该反应为可逆反应) |
实验室制法
| 化学方程式 | 现象 | |
|---|---|---|
| 与钾的反应 | 4K+O2=2K2O | 钾的表面变暗 |
| 2K+O2=K2O2 | ||
| K+O2=KO2(超氧化钾) | ||
| 与钠的反应 | 4Na+O2=2Na2O | 钠的表面变暗 |
| 产生黄色火焰,放出大量的热,生成淡黄色粉末 | ||
| 与镁的反应 | 2Mg+O2=点燃=2MgO | 剧烈燃烧发出耀眼的强光,放出大量热,生成白色粉末状固体。 |
| 与铝的反应 | 4Al+3O2=点燃=2Al2O3 | 发出明亮的光,放出热量,生成白色固体。 |
| 与铁的反应 | 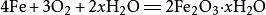 (铁锈的形成) (铁锈的形成) |
|
| 3Fe+2O2=点燃=Fe3O4 | 红热的铁丝剧烈燃烧,火星四射,放出大量热,生成黑色固体。 铁丝在充满氧气的集气瓶中燃烧 铁丝在充满氧气的集气瓶中燃烧 |
|
| 与锌的反应 | 2Zn+O2=点燃=2ZnO | |
| 与铜的反应 | 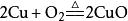 |
加热后亮红色的铜丝表面生成一层黑色物质。 |
工业制法
| 化学方程式 | 现象 | |
|---|---|---|
| 与氢气的反应 | 2H2+O2=点燃=2H2O | 安静地燃烧,产生淡蓝色的火焰,生成水并放出大量的热。[6] |
| 与碳的反应 | C+O2=点燃=CO2 | 剧烈燃烧,发出白光,放出热量,生成使澄清石灰水变浑浊的气体。 |
| 2C+O2=点燃=2CO (氧气不充足时) | ||
| 与硫的反应 | S+O2=点燃=SO2 | 在空气中燃烧,发出微弱的淡蓝色火焰;在纯氧中燃烧得更旺,发出蓝紫色火焰,放出热量,生成有刺激性气味的气体[7]。该气体能使澄清石灰水变浑浊,且能使酸性高锰酸钾溶液或品红溶液褪色,褪色的品红溶液加热后颜色又恢复为红色。 硫在氧气中燃烧 硫在氧气中燃烧 |
| 与红磷的反应 | 4P+5O2=点燃=2P2O5 | 发出耀眼白光,放热,生成大量白烟。 |
| 与白磷的反应 | 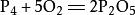 |
白磷在空气中自燃,发光发热,生成白烟。 |
| 与氮气的反应 | N2+O2=高温或放电=2NO |
主要用途
| 如甲烷、乙炔、酒精、石蜡等能在氧气中燃烧生成水和二氧化碳。气态烃类的燃烧通常发出明亮的蓝色火焰,放出大量的热,生成水和能使澄清石灰水变浑浊的气体。 | ||
| 甲烷 | CH4+2O2=点燃=CO2+2H2O | |
| 乙烯 | C2H4+3O2=点燃=2CO2+2H2O | |
| 乙炔 | 2C2H2+5O2=点燃=4CO2+2H2O | |
| 苯 | 2C6H6+15O2=点燃=12CO2+6H2O | 在空气中燃烧时,火焰明亮并有浓黑烟。 |
| 甲醇 | 2CH3OH+3O2=点燃=2CO2+4H2O | |
| 乙醇 | CH3CH2OH+3O2=点燃=2CO2+3H2O | |
| 烃的燃烧通式 | 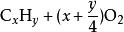 =点燃=xCO2+2yH2O(通式完成后应注意化简!下同) =点燃=xCO2+2yH2O(通式完成后应注意化简!下同) |
|
| 碳氢氧化合物与氧气发生燃烧的通式 | 4CxHyOz+(4x+y-2z)O2=点燃=4xCO2+2yH2O | |
| 乙醇被氧气氧化 | ||
| 氯仿与氧气的反应 | 2CHCl3+O2=2COCl2(光气)+2HCl | |
危险与防控
| 硫化氢的燃烧 | 2H2S+3O2(过量)=点燃=2H2O+2SO2[8]2H2S+O2(少量)=点燃=2H2O+2S[8] |
| 煅烧黄铁矿 | 4FeS2+11O2=高温=2Fe2O3+8SO2 |
| 二氧化硫的催化氧化 | 2SO2+O2←催化剂,△→2SO3 |
| 空气中硫酸酸雨的形成 | 2SO2+O2+2H2O=2H2SO4 |
| 氨在纯氧中的燃烧 | 4NH3+3O2(纯)=点燃=2N2+6H2O |
| 氨的催化氧化 | |
| 一氧化氮与氧气的反应 | 2NO+O2=2NO2 |
| 转化为臭氧的反应 | 3O2=放电=2O3(该反应为可逆反应) |
毒理学资料
中毒或泄漏处理
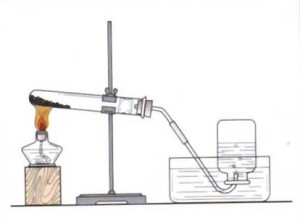 加热氯酸钾或高锰酸钾制取氧气1.加热高锰酸钾:
加热氯酸钾或高锰酸钾制取氧气1.加热高锰酸钾:
高锰酸钾热分解的方程式存在争议,因为其在不同温度条件下的分解产物会有差异
中学阶段反应方程式
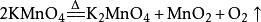
大学教材中反应方程式
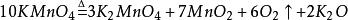
2.二氧化锰与氯酸钾共热: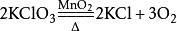 (制得的氧气中含有少量Cl2、O3和微量ClO2;部分教材已经删掉该制取方法;该反应实际上是放热反应,而不是吸热反应,发生上述1mol反应,放热108kJ)。
(制得的氧气中含有少量Cl2、O3和微量ClO2;部分教材已经删掉该制取方法;该反应实际上是放热反应,而不是吸热反应,发生上述1mol反应,放热108kJ)。
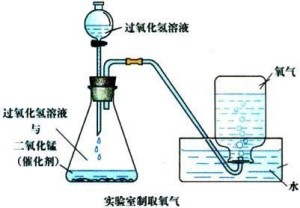 3.过氧化氢溶液催化分解(催化剂主要为二氧化锰,三氧化二铁、氧化铜也可):
3.过氧化氢溶液催化分解(催化剂主要为二氧化锰,三氧化二铁、氧化铜也可):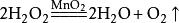 。
。
| 实验先查气密性,受热均匀试管倾。收集常用排水法,先撤导管后移灯。解释:1、实验先查气密性,受热均匀试管倾:“试管倾”的意思是说,安装大试管时,应使试管略微倾斜,即要使试管口低于试管底,这样可以防止加热时药品所含有的少量水分变成水蒸气,到管口处冷凝成水滴而倒流,致使试管破裂。“受热均匀”的意思是说加热试管时必须使试管均匀受热。2、收集常用排水法:意思是说收集氧气时要用排水集气法收集。3、先撤导管后移灯:意思是说在停止制氧气时,务必先把导气管从水槽中撤出,然后再移去酒精灯(如果先撤去酒精灯,则因试管内温度降低,气压减小,水就会沿导管吸到热的试管里,致使试管因急剧冷却而破裂)。 |
贮运方法
| 实验先查气密性,受热均匀试管倾。收集常用排水法,先撤导管后移灯。解释:1、实验先查气密性,受热均匀试管倾:“试管倾”的意思是说,安装大试管时,应使试管略微倾斜,即要使试管口低于试管底,这样可以防止加热时药品所含有的少量水分变成水蒸气,到管口处冷凝成水滴而倒流,致使试管破裂。“受热均匀”的意思是说加热试管时必须使试管均匀受热。2、收集常用排水法:意思是说收集氧气时要用排水集气法收集。3、先撤导管后移灯:意思是说在停止制氧气时,务必先把导气管从水槽中撤出,然后再移去酒精灯(如果先撤去酒精灯,则因试管内温度降低,气压减小,水就会沿导管吸到热的试管里,致使试管因急剧冷却而破裂)。 |
氧气的出现
1、分离液态空气法
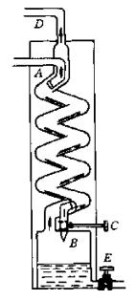 空气液化装置示意图在低温条件下加压,使空气转变为液态,然后蒸发,由于液态氮的沸点是‐196℃,比液态氧的沸点(‐183℃)低,因此氮气首先从液态空气中蒸发出来,剩下的主要是液态氧。
空气液化装置示意图在低温条件下加压,使空气转变为液态,然后蒸发,由于液态氮的沸点是‐196℃,比液态氧的沸点(‐183℃)低,因此氮气首先从液态空气中蒸发出来,剩下的主要是液态氧。
空气中的主要成分是氧气和氮气。利用氧气和氮气的沸点不同,从空气中制备氧气称空气分离法。首先把空气预冷、净化(去除空气中的少量水分、二氧化碳、乙炔、碳氢化合物等气体和灰尘等杂质)、然后进行压缩、冷却,使之成为液态空气。然后,利用氧和氮的沸点的不同,在精馏塔中把液态空气多次蒸发和冷凝,将氧气和氮气分离开来,得到纯氧(可以达到99.6%的纯度)和纯氮(可以达到99.9%的纯度)。如果增加一些附加装置,还可以提取出氩、氖、氦、氪、氙等在空气中含量极少的稀有惰性气体。由空气分离装置产出的氧气,经过压缩机的压缩,最后将压缩氧气装入高压钢瓶贮存,或通过管道直接输送到工厂、车间使用。使用这种方法生产氧气,虽然需要大型的成套设备和严格的安全操作技术,但是产量高,每小时可以产出数千、万立方米的氧气,而且所耗用的原料仅仅是不用买、不用运、不用仓库储存的空气,所以从1903年研制出第一台深冷空分制氧机以来,这种制氧方法一直得到最广泛的应用。
2、膜分离技术
膜分离技术得到迅速发展。利用这种技术,在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。利用这种膜进行多级分离,可以得到百分之九十以上氧气的富氧空气。
3、分子筛制氧法(吸附法)
利用氮分子大于氧分子的特性,使用特制的分子筛把空气中的氧离分出来。首先,用压缩机迫使干燥的空气通过分子筛进入抽成真空的吸附器中,空气中的氮分子即被分子筛所吸附,氧气进入吸附器内,当吸附器内氧气达到一定量(压力达到一定程度)时,即可打开出氧阀门放出氧气。经过一段时间,分子筛吸附的氮逐渐增多,吸附能力减弱,产出的氧气纯度下降,需要用真空泵抽出吸附在分子筛上面的氮,然后重复上述过程。这种制取氧的方法亦称吸附法.利用吸附法制氧的小型制氧机已经开发出来,便于家庭使用。
4、电解制氧法
把水放入电解槽中,加入氢氧化钠或氢氧化钾以提高水的电解度,然后通入直流电,水就分解为氧气和氢气。每制取一立方米氧,同时获得两立方米氢。用电解法制取一立方米氧要耗电12~15千瓦小时,与上述两种方法的耗电量(0.55~0.60千瓦小时)相比,是很不经济的。所以,电解法不适用于大量制氧。另外同时产生的氢气如果没有妥善的方法收集,在空气中聚集起来,如与氧气混合,容易发生极其剧烈的爆炸。所以,电解法也不适用家庭制氧的方法。
| 电解硫酸铜溶液 | 2CuSO4+2H2O=通电=2Cu↓+2H2SO4+O2↑ |
| 电解水 | 2H2O=通电=2H2+O2↑ |
| 光合作用总反应式 | 6CO2+6H2O—光,叶绿素→C6H12O6+6O2↑ |
| 浓硝酸受热或见光分解 | |
| 电解硝酸银溶液 | 4AgNO3+2H2O =通电=4Ag↓+4HNO3+O2↑ |
| 高铁酸钠受热分解(此反应有待考证) | |
| 氟气与水的反应 | |
| 电解铝 | 2Al2O3=通电=4Al+3O2↑ |
| 加热氧化铜 | 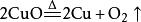 |
| 加热氧化汞 | 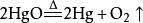 |
词条图册
| 电解硫酸铜溶液 | 2CuSO4+2H2O=通电=2Cu↓+2H2SO4+O2↑ |
| 电解水 | 2H2O=通电=2H2+O2↑ |
| 光合作用总反应式 | 6CO2+6H2O—光,叶绿素→C6H12O6+6O2↑ |
| 浓硝酸受热或见光分解 | |
| 电解硝酸银溶液 | 4AgNO3+2H2O =通电=4Ag↓+4HNO3+O2↑ |
| 高铁酸钠受热分解(此反应有待考证) | |
| 氟气与水的反应 | |
| 电解铝 | 2Al2O3=通电=4Al+3O2↑ |
| 加热氧化铜 | 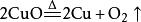 |
| 加热氧化汞 | 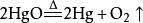 |



 求购
求购







