- 次氯酸

次氯酸
分子结构数据
| 摩尔折射率 | 8.43 |
| 摩尔体积(cm3/mol) | 37.4 |
| 等张比容(90.2K) | 87.3 |
| 表面张力(dyne/cm) | 29.6 |
| 极化率(10-24cm3) | 3.34 |
计算化学数据
| 摩尔折射率 | 8.43 |
| 摩尔体积(cm3/mol) | 37.4 |
| 等张比容(90.2K) | 87.3 |
| 表面张力(dyne/cm) | 29.6 |
| 极化率(10-24cm3) | 3.34 |
物理性质
| 疏水参数计算参考值(XlogP) | 0.3 |
| 氢键供体数量 | 1 |
| 氢键受体数量 | 1 |
| 可旋转化学键数量 | 0 |
| 互变异构体数量 | 0 |
| 拓扑分子极性表面积 | 20.2 |
| 重原子数量 | 2 |
| 表面电荷 | 0 |
| 复杂度 | 2 |
| 共价键单元数量 | 1 |
化学性质
| 疏水参数计算参考值(XlogP) | 0.3 |
| 氢键供体数量 | 1 |
| 氢键受体数量 | 1 |
| 可旋转化学键数量 | 0 |
| 互变异构体数量 | 0 |
| 拓扑分子极性表面积 | 20.2 |
| 重原子数量 | 2 |
| 表面电荷 | 0 |
| 复杂度 | 2 |
| 共价键单元数量 | 1 |
弱酸性
| 物质类别 | 无机酸 |
| 状态 | 仅存在于水溶液中。其水溶液在真空中可浓缩到密度为1.282g/cm3,即浓度40.1%。 次氯酸加热到40度以上时,分解速度是爆炸性的,且为极强氧化剂。 |
| 颜色 | 无色到浅黄绿(极浓时显黄绿色,因为溶有氯气,反应方程式为:9HClO==HClO3+4Cl2↑+O2↑+4H2O) |
| 气味 | 高浓度次氯酸有类似氯气的刺激性气味 |
| 溶解性(与水的体积比) | 1:2 |
强氧化性
| 物质类别 | 无机酸 |
| 状态 | 仅存在于水溶液中。其水溶液在真空中可浓缩到密度为1.282g/cm3,即浓度40.1%。 次氯酸加热到40度以上时,分解速度是爆炸性的,且为极强氧化剂。 |
| 颜色 | 无色到浅黄绿(极浓时显黄绿色,因为溶有氯气,反应方程式为:9HClO==HClO3+4Cl2↑+O2↑+4H2O) |
| 气味 | 高浓度次氯酸有类似氯气的刺激性气味 |
| 溶解性(与水的体积比) | 1:2 |
不稳定性
制备方法
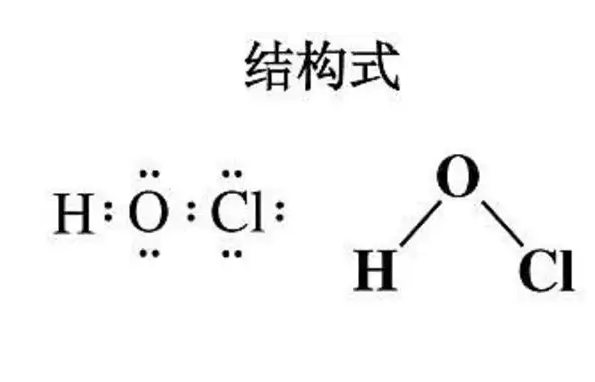 次氯酸(3)次氯酸是一元弱酸,25℃时的电离常数为3×10-8。
次氯酸(3)次氯酸是一元弱酸,25℃时的电离常数为3×10-8。
实验室制法
次氯酸能氧化还原性物质(如Na2SO3,FeCl2,KI,C7H7O4N(石蕊)等),使有色布条、品红褪色,并能使石蕊溶液变为无色液体。相关反应方程式如:Na2SO3+ HClO = Na2SO4+ HCl(强氧化剂制弱氧化剂,弱酸制强酸)。
次氯酸中性溶液是一种比标准状况下的氯更强的氧化剂:2HClO(aq)+2 H3O++2 e-⇌Cl2(g)+4H2O E=+1.63V。
工业制法
次氯酸很不稳定,只存在于水溶液中。浓次氯酸溶液呈淡黄色的原因是因为其不稳定,自发分解:2HClO→HCl+O₂↑,HClO+HCl→H2O+Cl₂↑。产生的氯气以分子形式溶于水呈淡黄色。次氯酸在溶液中发生3种形式的分解,它们彼此无关,称为平行反应,即:
1.2HClO → 2HCl+O₂↑
2.HClO+HCl →H₂O+Cl₂↑
3.3HClO → 2HCl+HClO₃
在阳光直接作用下,按第一种形式分解;在有脱水物质(如CaCl₂)存在时,按第二种形式分解;加热时特别容易按第三种形式分解。
其他制法
基本用途
由次氯酸钙与二氧化碳或草酸作用后过滤可得高纯滤液。
注意事项
由氯气、四氯化碳、水与氧化汞共摇荡后蒸馏而得。反应方程式为:Ca(ClO)₂+H₂O+CO₂→CaCO₃↓+2HClO。
词条图册
由氯气与水,生成次氯酸和盐酸,用碳酸钙增大浓度。反应方程式为:2H₂O+2Cl₂+CaCO₃→CaCl₂+H₂O+CO₂+2HClO。



 求购
求购






