- 离子凝聚

离子凝聚
概念
离子凝聚常用于检测乙肝表面抗原。检测方法有多种,如酶联免疫测定法(EIA)一步法、二步法、RIA法、电化学发光免疫测定法(ECLIA)等,医疗卫生单位检测乙肝标志物基本上应用EIA一步法进行定性测定,但该方法影响因素多,结果有时不准确。越来越多的人主张使用EIA二步法,但常规二步法最大的缺点是检测反应时间长达2h,给日常检验工作带来不便和病人等候时间长而少被应用。本研究是在EIA二步法中加入低离子凝聚胺溶液,旨在缩短反应时间,现将方法及结果报道如下。
材料方法
1、材料
(1)HBsAg质控血清购自卫生部临床检验中心,批号:200403。
(2)EIAHBsAg试剂盒购自上海科华公司。
(3)低离子介质凝聚胺溶液凝聚胺0.5 g、葡萄糖50 g、Na2EDTA 0.2 g、NaCl 8 g、KCl 2.9 g、KH2PO40.2 g、Na2HPO4·2H2O 2.9 g、蒸馏水1000 mL(4℃保存)。
(4)冼涤液枸椽酸三钠0.588 g加入试剂盒提供的PBS浓液,用蒸馏水稀释至200 mL。
(5)其他设备伯乐550酶标仪、振荡器、冼板机、水浴箱。
2、方法
(1)试剂盒放置室温平衡,每孔加入标本量50 μL,每孔加入低离子介质凝聚胺溶液50 μL,室温(25℃左右)振荡5 min,洗板4次。
(2)每孔加入酶标液2滴,振荡2 min,置37℃,5min,取出冼板5次。
(3)每孔加入显色剂A液、B液各1滴,充分混匀,封板。置37℃,15min,每孔加终止液1滴,混匀,用酶标仪读数,波长450 nm,10 min内完成。
研究分析
结果
![]() 表1 HBsAg各参考品S/CO值表最低检测量以样品吸光度值Cut/Off值(S/CO值)≥1判定为阳性,各质控品S/CO值见表1。表1可见,本方法最低检测量1ng/mL,符合卫生部有关最低检测量的要求。
表1 HBsAg各参考品S/CO值表最低检测量以样品吸光度值Cut/Off值(S/CO值)≥1判定为阳性,各质控品S/CO值见表1。表1可见,本方法最低检测量1ng/mL,符合卫生部有关最低检测量的要求。
讨论
凝聚胺介质溶液广泛用于血库交叉配血和血型鉴定,近来有报道用于肥达氏试验等方面抗原抗体测定,我们尝试用于乙型肝炎表面抗原测定,取得快速、特异的良好效果。血清学实验是抗原与抗体结合形成复合物的反应过程,凝聚胺是低离子聚合物,在水溶液中带强大的正电荷,能使抗原抗体之间的引力增加,距离缩短,增加有效碰撞,同时可解除抗原抗体复合物周围的电荷和水化膜,促进抗原抗体复合物的形成,极大地加速反应速度,缩短了结合反应时间。凝聚胺低离子介质聚合物可以形成非特异性抗原抗体反应,但我们在洗液PBS中加柠檬酸钠配成的洗液进行洗涤,可以消除这种现象,360份阳性标本测定结果与常规二步法测定结果比较完全一致。反应过程中,除低离子介质凝聚胺溶液外,电解质对抗原抗体完全结合亦相当重要,所以我们在试剂配制中加入了电解质和缓冲对物质。此外,充分振荡对增加抗原抗体之间的有效碰撞,加速抗原抗体复合物形成亦非常关键。
较多认为EIA二步法是测定乙肝表面抗原准确可靠的方法,陶洪群比较了ECLIA法和EIA一步法、二步法检测HBsAg结果,认为ECLIA法灵敏度高,自动化程度高,省时;EIA一步法受钩状效应影响明显,漏检率高;EIA二步法能较好避免钩状效应,敏感度高,漏检率低,但费时。单桂秋等对EIA一步法和二步法进行了分析,也认为EIA二步法结果可以消除一步法的前带钩状效应。虽然ECLIA一步法检测HBsAg优越,但设备试剂昂贵,收费高,加重病人的负担,一直来未能在医院特别是广大的基层医院广泛应用。而EIA一步法由于无需贵重仪器设备,且试剂价格便宜,操作简便快速被广泛应用于临床诊断,但其结果的准确性受到一定程度的影响;EIA二步法检测结果的准确可靠性已被公认,但其检测反应的时间长,不能充分满足临床和患者的需求而较少地推广使用。我们研究的低离子介质凝聚胺快速EIA二步法,反应过程仅需10min,经与常规EIA二步法对360份HbsAg阳性结果进行测定比较,结果与常规EIA二步法检测结果符合率一致,未见有前带和钩状效应的影响,消除了常规EIA二步法反应时间过长的因素,整个试验无需特殊设备,试剂配制简单,操作简便,易于掌握,特异性强,最低检测量符合卫生部的要求,值得推广应用。
DNA平衡离子凝聚的动态光散射分析
DNA作为一种生物大分子,与中性高分子和简单电解质相比,它是一种有着不同特性的聚电解质。当溶解于极性溶剂时,DNA将离解成高带电量的聚离子,且周围布满了许多小的平衡离子。由于DNA附近不同化合价的平衡离子分布不均匀,导致DNA的长程静电相互作用和熵发生变化,从而改变DNA的构型。
通常人们利用平衡离子凝聚理论,蒙特卡洛模拟或者通过解泊松-玻尔兹曼方程来研究聚电解质周围的平衡离子分布,这些理论研究结果表明平衡离子在聚电解质表面凝聚形成一种薄层结构。其中Manning的平衡离子凝聚理论通常用于描述在溶液中小离子与聚电解质的非特异性结合。强带电的线性聚电解质将吸附它周围的平衡离子,吸附的平衡离子中和了聚电解质上的电荷。
DNA是遗传信息的载体,细胞中的DNA必须凝聚成特定结构装载到细胞核中。因此,DNA凝聚在人工基因转移与转染过程、基因治疗和基因重组等方面有潜在的应用。从Manning的平衡离子凝聚理论可知,平衡离子能中和DNA上的大部分电荷,但DNA上还有部分未被中和的电荷,DNA分子之间还存在着静电排斥力。如何克服这个剩余静电排斥力,Shklovskii研究小组提出了一种新的理论解释。他们认为,由于强的横向排斥效应,平衡离子在DNA表面形成了一种类似Wigner晶体结构的强关联流体结构。吸附在DNA表面的平衡离子屏蔽了DNA的电荷,从而使得DNA间的排斥力减小,当DNA之间的静电排斥力小于静电吸引力时,DNA发生凝聚。多价平衡离子在DNA表面形成的强关联流体结构使得平衡离子的结合能大于kBT,这导致了更多的平衡离子吸附在DNA表面。当多价平衡离子的浓度达到一个临界值时,吸附在DNA表面的平衡离子的总电荷在绝对值上将大于DNA的电荷,使得DNA的净电荷的符号发生了反转,这种现象就叫做DNA的电荷反转。
单价和二价平衡离子与DNA的相互作用
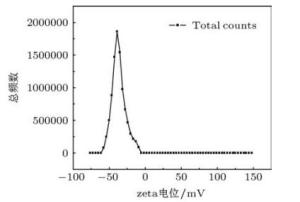 图1 DNA的Zeta电位分布图DNA可看成一种线性的强带电的聚电解质,且每个磷酸根基团都带有一个单位的负电荷,当溶于极性溶剂中,平衡离子将在DNA周围凝聚成一个薄层。根据Stern(斯特恩)模型,这个薄层应该分成两个部分:第一部分包括吸附在表面的一层离子,形成了一个内部紧密的双电层,称为Stern层;第二部分为Gouy-Chapman扩散层。按照Stern模型,DNA分子在运动时,应该与Stern层不可分离,似乎切动面就是Stern面。但是由于固体表面吸附的离子仍然保持者溶剂化(至少在扩散层的一侧),故DNA分子运动除了与吸附的平衡离子一起外,还会带着一薄层溶剂化的液体,因此实际运动的切动面应该在Stern面的更右侧一点,这个切动面上的电势就称为ζ(Zeta)电势或动电势。
图1 DNA的Zeta电位分布图DNA可看成一种线性的强带电的聚电解质,且每个磷酸根基团都带有一个单位的负电荷,当溶于极性溶剂中,平衡离子将在DNA周围凝聚成一个薄层。根据Stern(斯特恩)模型,这个薄层应该分成两个部分:第一部分包括吸附在表面的一层离子,形成了一个内部紧密的双电层,称为Stern层;第二部分为Gouy-Chapman扩散层。按照Stern模型,DNA分子在运动时,应该与Stern层不可分离,似乎切动面就是Stern面。但是由于固体表面吸附的离子仍然保持者溶剂化(至少在扩散层的一侧),故DNA分子运动除了与吸附的平衡离子一起外,还会带着一薄层溶剂化的液体,因此实际运动的切动面应该在Stern面的更右侧一点,这个切动面上的电势就称为ζ(Zeta)电势或动电势。
![图2 (a)MgCl2成像DNA的AFM图像;(b)[Co(NH3)6]3+导致DNA凝聚 图2 (a)MgCl2成像DNA的AFM图像;(b)[Co(NH3)6]3+导致DNA凝聚](https://pic.baike.soso.com/ugc/baikepic2/20255/20180220061804-215394365_png_295_551_241289.jpg/300) 图2 (a)MgCl2成像DNA的AFM图像;(b)[Co(NH3)6]3+导致DNA凝聚利用DLS技术分别测量了在缓冲液中只包含平衡离子Na+或Mg2+的情况下DNA的电泳迁移率随平衡离子浓度的变化,如图1所示。从图1中可以发现当平衡离子的浓度c<5 mM时,DNA的电泳迁移率随着平衡离子浓度的增大而逐渐减小,且平衡离子的化合价越大,DNA的电泳迁移率减小得越快。当c>5 mM时,DNA的电泳迁移率逐渐趋于稳定,且DNA分子的电泳迁移率µ1:µ2≈2:1,即缓冲液中只包含Na+或Mg2+时的电泳迁移率之比约为2:1,实验所得结果与Manning的理论值相符合。对于单价或者低浓度的二价的平衡离子,它们只是中和DNA双螺旋结构上的磷酸根基团所带的负电荷,而无法使DNA发生凝聚。通过AFM实验观察到,在低浓度的二价平衡离子的条件下DNA在溶液中是以自由舒展的形态存在,如图2中(a) 所示。正是由于低浓度的二价离子无法导致DNA凝聚,所以二价平衡离子常用于DNA分子的AFM成像。
图2 (a)MgCl2成像DNA的AFM图像;(b)[Co(NH3)6]3+导致DNA凝聚利用DLS技术分别测量了在缓冲液中只包含平衡离子Na+或Mg2+的情况下DNA的电泳迁移率随平衡离子浓度的变化,如图1所示。从图1中可以发现当平衡离子的浓度c<5 mM时,DNA的电泳迁移率随着平衡离子浓度的增大而逐渐减小,且平衡离子的化合价越大,DNA的电泳迁移率减小得越快。当c>5 mM时,DNA的电泳迁移率逐渐趋于稳定,且DNA分子的电泳迁移率µ1:µ2≈2:1,即缓冲液中只包含Na+或Mg2+时的电泳迁移率之比约为2:1,实验所得结果与Manning的理论值相符合。对于单价或者低浓度的二价的平衡离子,它们只是中和DNA双螺旋结构上的磷酸根基团所带的负电荷,而无法使DNA发生凝聚。通过AFM实验观察到,在低浓度的二价平衡离子的条件下DNA在溶液中是以自由舒展的形态存在,如图2中(a) 所示。正是由于低浓度的二价离子无法导致DNA凝聚,所以二价平衡离子常用于DNA分子的AFM成像。
三价平衡离子与DNA的相互作用
多价阳离子能导致DNA的形态发生变化。由于DNA双螺旋结构上带负电荷的磷酸根基团之间的静电排斥作用,DNA在溶液中是以自由舒展的形式存在。而这些多价阳离子能中和DNA双螺旋结构上的磷酸根基团所带的负电荷,从而使磷酸根基团间的静电排斥力减小,导致DNA的形态发生改变。当多价阳离子的浓度大于临界值时,DNA分子将凝聚成特定的紧密结构。本文通过DLS实验研究了DNA的电泳迁移率与三价平衡离子[Co(NH3)6]3+浓度的变化关系。
当DNA溶液中加入三价离子,这些三价离子结合在磷酸根基团和氮基位点上使得DNA上的负电荷大部分被中和。通过观察AFM图像,可知[Co(NH3)6]3+可使DNA分子发生凝聚,凝聚结构为花状结构,如图2中(b)所示。根据文献可知,当平衡离子的化合价Z>3时,DNA发生凝聚,这表明多价离子的化合价越高,越容易使DNA发生凝聚。在溶液中多价离子导致DNA凝聚,此时的DNA电泳迁移率不仅与DNA上的有效电荷有关,而且可能与DNA的结构有关。由于在理论上我们假设DNA的迁移率只与它的有效电荷有关,而不考虑DNA的结构的变化,所以我们得出的实验结果与理论数据有明显偏离。
研究结论
系统地研究了不同化合价的平衡离子与DNA之间的相互作用。动态光散射的实验结果表明当溶液中只存在单价平衡离子或者二价平衡离子时,其实验结果与Manning的平衡离子凝聚理论结果相符合。当溶液中的平衡离子的化合价Z>3时,DNA发生凝聚,此时DNA的电泳迁移率不仅与DNA上的有效电荷有关,还可能与DNA的结构有关,所以测得的实验结果大于理论值。当平衡离子的化合价Z=4时,DNA的电荷发生反转,这主要是由于吸附在DNA表面的多价离子的总电荷大于裸DNA的电荷的绝对值。因此,对于一般情形,自由溶液中的聚电解质的构型和离子关联效应与聚电解质迁移过程密切相关。

-
离子减薄仪及处理附件
2025-09-19 09:50:11 查看详情


 求购
求购









