- 电离

电离
基础定义
电解质在 水溶液中或 熔融状态下离解成自由移动阴阳离子的过程。将电子从 基态激发到脱离 原子,叫做电离,这个过程所需的 能量叫电离 电势能。例如 氢原子中 基态的 能量为-13.6eV( 电子伏特),使电子电离的电离势能就是13.6eV(即2.18×10-18焦耳)。简单点说,就是电解质在水溶液中或熔融状态下产生自由移动的离子过程。
应用举例
气体电离的日常例子,如在荧光灯或其它放电灯。它也被用于辐射探测器如盖革计数器、电离室。电离过程被广泛应用于基础科学,如质谱和放射治疗的各种设备。
阴阳离子
 电离 原子是由 原子核及其周围的带负电的电子所组成。 原子核由带正电的质子和不带电的中子构成,由于质子所带的 正电荷数与电子的 负电荷数相等所以原子是中性的。原子最外层的电子称为价电子。所谓电离,就是原子受到外界的作用如被加速的电子或离子与原子碰撞时使原子中的外层电子特别是价电子摆脱原子核的束缚而脱离,原子成为带一个或几个 正电荷的离子这就是阳离子。如果在碰撞中原子得到了电子,则成为阴 离子。
电离 原子是由 原子核及其周围的带负电的电子所组成。 原子核由带正电的质子和不带电的中子构成,由于质子所带的 正电荷数与电子的 负电荷数相等所以原子是中性的。原子最外层的电子称为价电子。所谓电离,就是原子受到外界的作用如被加速的电子或离子与原子碰撞时使原子中的外层电子特别是价电子摆脱原子核的束缚而脱离,原子成为带一个或几个 正电荷的离子这就是阳离子。如果在碰撞中原子得到了电子,则成为阴 离子。
经典电离
只适用于经典物理和玻尔模型,使原子和分子电离完全确定性,即每一个问题,始终有一个明确的和可计算的答案。
电离的产生
带负电荷的离子时所产生的自由电子和原子相碰撞,随后被困在电势垒,释放多余的能量。这个过程被称为电子俘获电离。
带正电荷的离子通过能量传输足够数量的束缚电子与带电粒子碰撞产生的(例如,离子,电子或正电子)或光子。所需的能量阈值的量被称为电离电位。这种碰撞的研究是关于少体问题的根本重要性(见少体系统的文章),这是物理学的一个主要的未解决的问题。运动学完整的实验,即实验的所有碰撞碎片完整的动量矢量(散弹,反冲靶离子,和喷射的电子)被确定,有助于在近年来少体问题的理论认识的重大进展。
 电离
电离
原子电离能
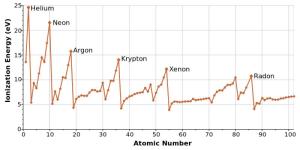
原子的电离能的趋势是经常被用来证明相对于原子的原子数的周期行为,如门捷列夫的原子排列的表了。这是建立和理解电子在原子轨道波函数的排序没有进入或电离过程的细节的一个有价值的工具。例如图1所示。周期性的急剧降低,电离稀有气体原子,比如后,表明在碱金属的一种新的壳的出现。此外,在电离能量图的局部极大值,从左到右一行,表示S,P,D,F子炮弹。
电离类型
电离有两种,一种是化学上的电离,另一种是物理上的电离。电离通常包含物理过程和化学过程,物理过程就是溶解,化学过程不是 化学变化。化学变化除了旧键的断裂还要有新键的生成,所以电离不是化学变化。而化学过程指的是在溶剂 分子(如 水分子)作用下,电解质 中原有的一部分化学键断裂。有的电离过程断裂的化学键是 离子键,如氯化钠等大多数 盐类的电离, 氢氧化钠等大多数碱的电离。也有的电离过程断裂的是 共价键,如 硫酸的电离,氯化氢的电离等等。
化学电离
化学上的电离是指电解质在一定条件下(例如溶于某些溶剂、加热熔化等),电离成可自由移动的离子的过程。在电离前可能是不含有离子(例如氯化氢),也可能是尽管有离子,但是里面的离子不能自由移动(例如 氯化钠 固体)。电离时生成的阳离子全部是 氢离子(H +),它的化合物叫做酸,在水溶液中 电离而生出的阴离子全部是 氢氧根离子(OH -)的 化合物叫做 碱。如果我们的思维突破以水为 介质,问题类似的转移, 比如在 液氨为 溶剂的情况下,如果溶质电离产生阳离子的物质就是 酸,电离产生 阴离子的物质就是碱了,下面就总结一下经常遇到也是很少遇到一些溶剂本身 自偶电离产生的阴阳离子,便于我们做一些判断,或者提高我们的思维的深度和广度:
H2O→H + + OH -
2NH 3→NH 4 + + NH 2 -
2SO 2→SO 2++ SO3 2-
物理电离
物理上的电离是指不带电的 粒子在高压电弧或者高能 射线等的作用下,变成了带电的粒子的过程。例如地球的 大气层中的 电离层里的粒子就属于这种情况。电离层中的粒子在 宇宙中的高能射线的作用下,电离成了带电的粒子。物理电离的方式有高温、电场与高能辐射。
电离相关
电离吸放热
固体 溶质 进入溶液后,首先发生 微粒(分子或离子)的扩散(吸热)过程,接着是形成 水合离子或水合分子的水合过程(放热)。这里有 化学键的破坏和形成,严格说都是物理-化学过程。对于强电解质来说, 溶解和电离是难以截然分开的,因为离子的扩散就是电离。不过对于弱电解质说来,首先是扩散成分子(吸热),然后在水分子作用下, 化学键被破坏而电离成为水合的自由离子(这里总体表现是吸热还是放热要看破坏化学键需要的 能量多,还是水合释放能量多了,因此,电离过程不一定是吸热)。
完全电离和不完全电离
电离有完全电离和不完全电离之分。 强电解质在水溶液中是完全电离的,如 硫酸、氯化钠、氢氧化钠等。 弱电解质在水溶液中呈现不完全电离状态,如氯化汞的电离, 硫化氢的电离等。
电离和电解的区别
应当注意,电离与电解 是有区别的。电离过程根本不需要通电(会电离的物质,只要溶解在特定溶剂里就会电离),而电解则需要外部通以 电流。
相关概念
电解质
凡是在水溶液或熔融状态下能够解离成阳离子与阴离子而导电的化合物叫电解质。例如酸、碱、盐、活泼金属氧化物、过氧化物、氢化物等。在水溶液或熔融状态下都不能导电的化合物叫非电解质。电解质和非电解质的区别就在于溶于水或熔融状态下能否导电。[2]
离子化合物和某些具有极性的共价化合物在水溶液里全部电离为离子,没有分子存在,这样的电解质属于强电解质。强酸、强碱、大部分盐类都是强电解质。弱酸、弱碱、水等化合物在水溶液中部分电离成离子,存在电解质分子和离子之间的电离平衡,是弱电解质。电解质在溶剂中能否完全电离是区分强电解质和弱电解质的依据。 [2]
电离平衡
一定温度下,弱电解质溶液中当弱电解质分子电离成离子的速率与离子重新结合成分子的速率相等时,弱电解质分子和离子浓度不再改变的状态称为弱电解质的电离平衡。[2]
电离度
在一定温度下,一定浓度的弱电解质溶液中,弱电解质达到电离平衡时,已电离的电解质分子数占原来总分子数的百分数,称作该电解质的电离度,用α表示。一般来说,在相同条件下,电解质越强,电离度越大,因此弱电解质的相对强弱,可用电离度的大小定量表示。[2]
电离常数
在一定温度下,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数,又称电离常数或离解常数,用Ki表示。[2]
电离辐射
电离辐射,是指能直接或间接引起物质原子电离的辐射,是原子以电磁波或粒子形式传递时所释放的一种能量。早在1895年11月德国物理学家伦琴发现了一种看不见但能穿透物质的射线,称为X射线,X射线被发现后不久即在医学中得到应用。1896年3月,法国科学家贝克勒尔发现铀元素能发射出一种不可见的具有穿透力的辐射,能使空气电离和胶片感光。1898年7月,居里夫妇首次从沥青铀矿中提炼出一种新元素,命名为钋(Po),同年12月又成功分离出另一种新元素镭(Ra),并提出了一个新名词“放射性”。在核事业发展的早期,用于研究和应用的辐射源主要是来自自然界的放射性物质,如可支撑γ射线源的镭、可制成中子源的镭-铍混合物等,并通常被封装在小容器内,以达到使用安全和操作方便的目的。此后,随着核反应堆的发展,出现了人工放射性核素,辐射源的种类及其应用日益繁多,使用量也不断增加。目前,核技术已广泛应用于国防、科研、工业、农业、医学、通讯、交通、环保、资源开发和科学研究等各个领域,对促进人类文明建设发挥了不可替代的作用。[3]
元素的电离能
在正常状态下,原子处于最低能级,这时电子在离核最近的轨道上运动,这种状态叫基态。某元素的处于基态的一个气态原子失去一个电子形成一个+1价的气态阳离子时所需要的能量,叫作这种元素的第一电离能,用I1表示。使某元素的一个+1价的气态阳离子失去一个电子形成一个+2价的气态阳离子时所需的能量,叫作这种元素的第二电离能,用I2表示。依此类推,还有元素的第三电离能、第四电离能等,通常所说的电离能一般指第一电离能。电离能的大小可以用来衡量元素的原子失电子的难易程度,电离能越小,失电子越容易,金属性越强。一般地,同一元素随着原子失去电子数的增加,失电子越来越难,因此同一元素的各级电离能依次升高。[4]



 求购
求购






