- 离子

离子
词语释义
在 化学变化中,原子或原子团得失电子后形成的带电微粒称作离子。带正电的称为 阳离子,带负电的称为 阴离子。
原子是由 原子核和核外电子构成,原子核带 正电荷,绕核运动的电子则带相反的 负电荷。原子的 核电荷数与核外 电子数相等,因此原子显电中性。如果原子从外获得的 能量超过某个壳层电子的结合能,那么这个电子就可脱离原子的束缚成为 自由电子。
原子核外第一层不能超过2个电子,最外层最多只能排8个。次外层不超过18个。
一般 最外层电子数小于4的原子、或 半径较大的原子,较易失去电子(一般为 金属元素,如: 钾K, 钙Ca等)趋向达到相对稳定结构;而最外层电子数不少于4的原子(一般为 非金属元素,如: 硼B, 碳C等)则较易获得电子趋向达到相对稳定结构。
当原子的最外层电子轨道达到 饱和状态(第一 周期 元素2个电子、第二第三周期元素8个电子)时,性质最稳定,一般为 稀有气体(氦除外,最外层有2个电子,性质也很稳定)。
离子是指原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个(如第一层是最外层,则为2个,若是 氢离子,则没有外层电子)的稳定结构。这一过程称为 电离。电离过程所需或放出的能量称为 电离能。
在 化学反应中, 金属 元素 原子失去最外层电子, 非金属原子得到电子,从而使参加反应的原子或 原子团带上电荷。带电荷的原子叫做离子,带正电荷的原子叫做 阳离子,带负电荷的原子叫做 阴离子。阴、阳离子由于 静电作用而形成不带电性的 化合物。
与 分子、原子一样,离子也是构成物质的 基本 粒子。如 氯化钠就是由 氯离子和 钠离子构成的。
分类
当原子得到一个或几个电子时,质子数 小于核外 电子数,且 质子数=核外电子数-所带电荷数,从而带负电荷,称为 阴离子。
当原子失去一个或几个电子时,质子数大于核外电子数,且 质子数=核外 电子数+所带 电荷数,从而带 正电荷,称为 阳离子。
络离子是指由某些分子、原子或阳离子通过 配位键与电 中性分子或 阴离子形成的复杂离子,例如 水合离子。络离子本身可以属于阳离子或阴离子。
属性
在 化合物的原子间进行 电子转移而生成离子的过程称为 电离,电离过程所需或放出的能量称为 电离能。电离能越大,意味着原子越难失去电子。 离子化合物,即阴、阳离子间以 离子键组成的化合物,如可溶于水的酸、碱、 盐,当在水中 溶解并 电离时,恒定条件下,处于离子状态的比例和处于分子状态的比例达到 动态平衡,称为 离子平衡(ion balance)。
结构示意
离子结构示意图与 原子结构示意图一样,人们可以用离子结构示意图来表示离子的 核电荷数和 电子层排布。小圈和圈内的数字分别表示 原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的 电子数。当然,在书写离子结构的时候需要注意离子核外电子一般为8电子(或2电子)的稳定结构。
发现简史
1887年,28岁的 阿仑尼乌斯在前人研究的  离子基础上提出了 电离理论。但他的导师,著名科学家 塔伦教授不认同他的观点,严厉抨击了他的论文,结果 电离学说在数年后才受到公认。阿仑尼乌斯荣获1903年 诺贝尔化学奖。后来物理学家 德拜对离子作了进一步研究并获得1936年 诺贝尔化学奖。 等离子态与气体放电:在绝对 温度不为零的任何气体中。
离子基础上提出了 电离理论。但他的导师,著名科学家 塔伦教授不认同他的观点,严厉抨击了他的论文,结果 电离学说在数年后才受到公认。阿仑尼乌斯荣获1903年 诺贝尔化学奖。后来物理学家 德拜对离子作了进一步研究并获得1936年 诺贝尔化学奖。 等离子态与气体放电:在绝对 温度不为零的任何气体中。
气体元素离子
都有一定数量的原子被电离。在气体放电过程中以及受控 聚变装置产生的 高温等离子体中,有大量的工作气体 原子和杂质原子被剥离了最外层电子,成为离子。例如氧原子,若失去一个电子记作OⅡ,若失去两电子记作OⅢ,以此类推。
检验
离子检验指的是通过用 指示剂、 沉淀、 冒泡等方法鉴别离子的过程。
酸根
SO 4 2-(在溶液中)———先加入稀 盐酸酸化,如果无沉淀生成、无气体产生(分别排除 银离子、 碳酸根离子干扰)则在被测溶液中加入 氯化钡溶液,生成白色沉淀则原被测液中含 硫酸根离子。
CO 3 2-(1)( 固体或溶液)———在被测 物质中加入稀酸溶液,如果产生能使澄清 石灰水变浑浊的气体,则原被测物质中含碳酸根离子。(2)(在溶液中)———在被测溶液中加入氯化钡或 硝酸银溶液,如果产生能溶于硝酸的白色沉淀,且同时生成能使澄清的 石灰水变浑浊的气体,则原被测溶液中含碳酸根离子。
金属离子
NH 4 + (溶液或固体)———在被测物质中加入 强碱如NaOH,研磨或加热,如果放出刺激性气体,且该气体能使湿润的 红色石蕊试纸变蓝,则原物质中含有 铵根离子。
Fe 2+ (溶液)———在被测溶液中加入KSCN溶液,无现象,再加入新制 氯水,然后,如果产生血红色沉淀,则原被测溶液中含有 亚铁离子。
Fe 3+ (溶液中)———在被测物质中加入KSCN溶液,如果产生血红色沉淀,则原被测溶液中含有铁离子。
Na + (固体或溶液)———用焰色反映检验,如果其 火焰为黄色,则原物质中含有钠离子。
K + (固体或溶液)———用焰色反映检验,如果其火焰为紫色(透过蓝色 钴玻璃,滤去黄光),则原物质中含有 钾离子。
 离子
离子
非金属离子
Cl -(在溶液中)———在被测溶液中加入稀硝酸酸化,然后加入 硝酸银溶液。如果生成白色沉淀,则原被测液中含氯离子。
Br - (溶液)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的浅黄色沉淀,则原被测液中含 溴离子。
I - (溶液)———在被测溶液中加入硝酸银溶液,如果生成不溶于硝酸的黄色沉淀,则原被测液中含碘离子。
注:
在鉴别 硫酸根离子时,用氯化钡溶液,不能用硝酸银或硝酸钡溶液,这是因为硫酸银为微溶性物质,使鉴别现象不明显;且硝酸根很可能将亚硫酸根氧化为硫酸根,造成结果不对。
检验硫酸根离子时在不能直接加入氯化钡溶液,若产生不溶于硝酸的白色沉淀,则原被测液中可能含银离子也可能含硫酸根离子,所以应先加盐酸酸化并排除银离子。
符号
离子符号:在元素符号右上角表示出离子所带正、负电荷数的符号。 例如,钠原子失去一个电子后成为带一个单位正电荷的钠离子用“Na+”表示。硫原子获得二个电子后带元素符号:统一采取该元素的拉丁文名称第一个字母来表示元素的符号(往往正负电的数字写在 正负号的前面)。
离子键
 离子
离子
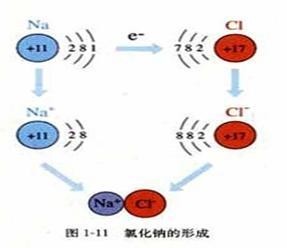
离子键 :使阴、 阳离子结合成化合物的 静电作用。
离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即 正离子和 负离子之间由于 静电引力所形成的 化学键。离子既可以是单离子,如Na +、Cl -;也可以由 原子团形成;如SO 4 2-,NO 3 -等。离子键的作用力强,无饱和性,无方向性。离子键形成的矿物总是以 离子晶体的形式存在。
研究认为,在分子或晶体中的原子决不是简单地堆砌在一起,而是存在着强烈的相互作用。化学上把这种分子或晶体中原子间(有时原子得失电子转变成离子)的强烈作用力叫做化学键。键的实质是一种力。所以有的又叫键力,或就叫键。
矿物都是由原子、分子或离子组成的,它们之间是靠化学键联系着的。
化学键主要有 三种基本类型,即 离子键、 共价键和 金属键。
离子键的形成 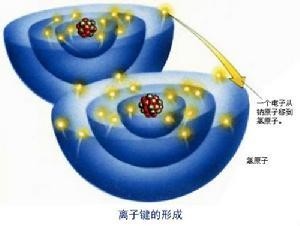 离子强,有饱和性与方向性。因为只有 自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外, 原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。共价键又可分为三种:
离子强,有饱和性与方向性。因为只有 自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外, 原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。共价键又可分为三种:
1.非 极性共价键形成共价键的电子云正好位于键合的两个原子正中间,如金刚石的C—C键。
2.极性共价键 形成共价键的电子云偏于对电子引力较大的一个原子,如Pb—S 键,电子云偏于S一侧,可表示为Pb→S。
3.配价键 共享的电子对只有一个原子单独提供。如Zn—S键,共享的电子对由锌提供,Z:+ ¨..S:=Z n→S 共价键可以形成两类晶体,即 原子晶体共价键与 分子晶体。 原子晶体的晶格结点上排列着原子。原子之间有共价键联系着。在分子晶体的 晶格结点上排列着分子(极性分子或非极性分子),在分子之间有 分子间力作用着,在某些晶体中还存在着 氢键。
离子间的反应
凝固成 液氯、 液氨和 干冰( 二氧化碳的晶体)。说明在分子之间还有一种 作用力存在着,这种作用力叫做分子间力( 范德华力),有的叫 分子键。分子间力的分子的 极性有关。 分子有极性分子和非极性分子,其根据是分子中的正负电荷中心是否重合,重合者为非极性分子,不重合者为极性分子。 分子间力包括三种作用力,即 色散力、 诱导力和 取向力。
(1)当非极性分子相互靠近时,由于电子的不断运动和原子核的不断振动,要使每一瞬间正、负电荷中心都重合是不可能的,在某一瞬间总会有一个偶极存在,这种偶极叫做瞬时偶极。由于同极相斥,异极相吸,瞬时偶极之间产生的分子间力叫做 色散力。任何分子(不论极性或非极性)互相靠近时,都存在色散力。
(2)当极性分子和 非极性分子靠近时,除了存在色散力作用外,由于非极性分子受极性分子电场的影响产生诱导偶极,这种诱导偶极和极性分子的固有偶极之间所产生的吸引力叫做诱导力。同时诱导偶极又作用于极性分子,使其偶极长度增加。从而进一步加强了它们间的吸引。
(3)当 极性分子相互靠近时,色散力也起着作用。此外,由于它们之间固有偶极之间的同极相斥, 异极相吸,两个分子在空间就按异极相邻的状态取向,由于固有偶极之间的取向而引起的分子间力叫做 取向力。由于取向力的存在,使极性分子更加靠近,在相邻分子的固有偶极作用下,使每个分子的正、负电荷中心更加分开,产生了诱导偶极,因此极性分子之间还存在着 诱导力。
总之,在非极性分子之间只存在着色散力,在极性分子和非极性分子之间存在着色散务和诱导力,在极性分子之间存在着色散力、诱导力和取向力。色散力、诱导力和 取向力的总和叫做分子间力。分子间力没有方向性与饱和性,键力较弱。
特征
离子是组成离子型化合物的 基本粒子。离子型化合物在任何状态下(晶体、 熔融状态、蒸气状态或溶液中)都是以离子的形式存在的。因此,离子的性质在很大程度上决定着离子化合物的性质。就是说,离子的性质,即离子的三种重要特征:离子的电荷、离子的半径、离子的电子层结构的类型(简称离子的 电子构型)是决定离子型化合物的共性和特性的根本原因。
(1)离子的电荷
离子 电荷对于离子的性质以及所组成的离子型 化合物的性质,都有很大影响。即使是同一种元素,当形成不同电荷的离子时,由它们所组成的离子型化合物的性质也会有较大的差异。例如,铁元素能形成Fe 2+、Fe 3+两种离子,这两种离子及其化合物在性质上就大不相同。Fe 3+比Fe 2+的正电荷多,在一定条件下,Fe 3+能夺取1个电子变成Fe 2+,而相反,Fe 2+则有失去1个电子变为Fe 3+的倾向。Fe 3+在溶液中能跟SCN -离子作用生成血红色的Fe(SCN) 2+离子,而Fe 2+则不发生这种反应;Fe 3+在 水溶液里呈黄色,Fe 2+在水溶液里却呈浅绿色等。
(2)离子的电子构型
离子的电子层结构类型不同,对离子化合物的性质亦有一定的影响,例如,Na和Cu离子的电荷数相同,都是+1价的离子,它们的离子半径也很相近,Na的半径是0.095 nm,Cu的半径是0.096 nm,但它们相应的化合物的性质却有较大的差别:如 NaI易溶于水,而CuI不易溶于水。这主要是由于Na的 电子构型(2s 2p)和Cu的电子构型(3s 3p 3d)很不相同。
(3)离子的半径
原子或离子的绝对大小是无法确定的,因为原子核外电子并非在固定的轨道上运动。而通常说的 离子半径是指离子的有效半径,它是通过各种结构分析实验测定两个异号离子A和B所组成的离子型化合物的核间距d求算出来的。而d等于A的半径r 1与B的半径r 2之和,即
d=r 1+r 2
由此可见,离子半径只能近似地反映离子的大小,离子半径随配位数、离子的价数等等而改变。
离子半径求算时,必须假设某个离子的r1为已知,然后依据r 2=d-r 1公式求出r 2。1926年,戈尔德施米特由晶体结构数据确定了氟离子和氧离子的半径分别是0.133 nm和0.132 nm,然后以此为基准,一一推算出其他各离子的半径。
定义一:描述离子大小的参数。取决于 离子 所带 电荷、 电子分布 和晶体结构型式
离子半径 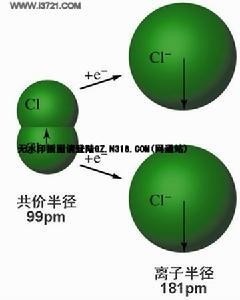 离子电荷、 电子分布和 晶体结构型式。设r阳为阳 离子半径,r阴为阴离子半径。r阳+r阴= 键长。r阳/r阴与晶体类型有关。可从 键长计算离子半径。一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构 配位数为6的数据。Shannon考虑了配位数和 电子自旋状态的影响,得到两套最新数据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大14pm,阴离子小14pm,更接近晶体实际。 定义二:反映离子大小的一个 物理量。离子可近似视为球体, 离子半径的导出以正、 负离子半径之和等于 离子键 键长这一 原理为基础,从大量X射线 晶体结构分析实测键长值中推引出离子半径。 离子半径的大小主要取决于离子所带电荷和离子本身的 电子分布,但还要受离子化合物结构型式(如 配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、 负离子的半径和及 半径比,这是阐明 离子化合物 性能和 结构型式的两项重要因素。
离子电荷、 电子分布和 晶体结构型式。设r阳为阳 离子半径,r阴为阴离子半径。r阳+r阴= 键长。r阳/r阴与晶体类型有关。可从 键长计算离子半径。一般采用Goldschmidt半径和Pauling半径,皆是NaCl型结构 配位数为6的数据。Shannon考虑了配位数和 电子自旋状态的影响,得到两套最新数据,其中一套数据,参考电子云密度图,阳离子半径比传统数据大14pm,阴离子小14pm,更接近晶体实际。 定义二:反映离子大小的一个 物理量。离子可近似视为球体, 离子半径的导出以正、 负离子半径之和等于 离子键 键长这一 原理为基础,从大量X射线 晶体结构分析实测键长值中推引出离子半径。 离子半径的大小主要取决于离子所带电荷和离子本身的 电子分布,但还要受离子化合物结构型式(如 配位数等)的影响,离子半径一般以配位数为6的氯化钠型晶体为基准,配位数为8时,半径值约增加3% ;配位数为4时,半径值下降约5%。负离子半径一般较大,约为1.3~2.5埃;正离子半径较小,约为0.1~1.7埃。根据正、负离子半径值可导出正、 负离子的半径和及 半径比,这是阐明 离子化合物 性能和 结构型式的两项重要因素。
常见离子
阳离子
1.简单阳离子
名称 |
化学式 |
别称 |
|---|---|---|
铝离子 |
Al 3+ |
|
钡离子 |
Ba 2+ |
|
铍离子 |
Be 2+ |
|
铯 离子 |
Cs + |
|
钙离子 |
Ca 2+ |
|
铬离子(II) |
Cr 2+ |
|
铬离子(III) |
Cr 3+ |
|
铬离子(VI) |
Cr 6+ |
|
钴离子(II) |
Co 2+ |
|
钴离子(III) |
Co 3+ |
|
亚铜离子(I) |
Cu + |
|
铜离子(II) |
Cu 2+ |
|
铜离子(III) |
Cu 3+ |
|
镓 离子 |
Ga 3+ |
|
氦离子 |
He 2+ |
α个子 |
氢离子 |
H + |
质子 |
亚铁离子(II) |
Fe 2+ |
|
铁离子(III) |
Fe 3+ |
|
铅离子(II) |
Pb 2+ |
|
铅离子(IV) |
Pb 4+ |
|
锂离子 |
Li + |
|
镁离子 |
Mg 2+ |
|
锰离子(II) |
Mn 2+ |
|
锰离子(III) |
Mn 3+ |
|
锰离子(IV) |
Mn 4+ |
|
锰离子(VII) |
Mn 7+ |
|
汞离子(II) |
Hg 2+ |
|
亚镍离子(II) |
Ni 2+ |
|
镍离子(III) |
Ni 3+ |
|
钾 离子 |
K + |
|
银 离子 |
Ag + |
|
钠离子 |
Na + |
|
锶离子 |
Sr 2+ |
|
亚锡离子(II) |
Sn 2+ |
|
锡离子(IV) |
Sn 4+ |
|
金离子 |
Au 3+ |
|
锌 离子 |
Zn 2+ |
2. 多原子阳离子
铵根离子 |
NH 4 + |
水合氢离子 |
H 3O + |
硝鎓离子 |
NO 2 + |
亚汞(I) |
Hg 2 2+ |
阴离子
1.简单阴离子
名称 |
化学式 |
合称 |
|---|---|---|
砷离子 |
As 3− |
砷化物 |
叠氮根离子 |
N3 − |
叠氮化物 |
溴离子 |
Br − |
溴化物 |
氯离子 |
Cl − |
氯化物 |
氟离子 |
F − |
氟化物 |
氢负离子 |
H − |
氢化物 |
碘离子 |
I − |
碘化物 |
氮离子 |
N 3− |
氮化物 |
氧离子 |
O 2− |
氧化物 |
磷离子 |
P 3− |
磷化物 |
硫离子 |
S 2− |
硫化物 |
过氧根离子 |
O 2 2− |
过氧化物 |
2. 含氧酸根
名称 |
化学式 |
合称 |
|---|---|---|
砷酸根离子 |
AsO 4 3− |
砷酸盐 |
亚砷酸根离子 |
AsO 3 3− |
亚砷酸盐 |
硼酸根离子 |
BO 3 3− |
硼酸盐 |
溴酸根离子 |
BrO 3 − |
溴酸盐 |
次溴酸根离子 |
BrO − |
次溴酸盐 |
碳酸根离子 |
CO 3 2− |
碳酸盐 |
碳酸氢根离子 |
HCO 3 − |
碳酸氢盐 |
氢氧根离子 |
OH − |
氢氧化物 |
氯酸根离子 |
ClO 3 − |
氯酸盐 |
高氯酸根离子 |
ClO 4 − |
高氯酸盐 |
亚氯酸根离子 |
ClO 2 − |
亚氯酸盐 |
次氯酸根离子 |
ClO − |
次氯酸盐 |
铬酸根离子 |
CrO 4 2− |
铬酸盐 |
二铬酸根离子 |
Cr 2O 7 2− |
二铬酸盐 |
碘酸根离子 |
IO 3 − |
碘酸盐 |
硝酸根离子 |
NO 3 − |
硝酸盐 |
亚硝酸根离子 |
NO 2 − |
亚硝酸盐 |
磷酸根离子 |
PO 4 3− |
磷酸盐 |
亚磷酸根离子 |
HPO 3 2− |
亚磷酸盐 |
磷酸一氢根离子 |
HPO 4 2− |
磷酸一氢盐 |
磷酸二氢根离子 |
H 2PO 4 − |
磷酸二氢盐 |
锰酸根离子 |
MnO 4 2− |
锰酸盐 |
高锰酸根离子 |
MnO 4 − |
高锰酸盐 |
硫酸根离子 |
SO 4 2− |
硫酸盐 |
硫代硫酸根离子 |
S 2O 3 2− |
硫代硫酸盐 |
硫酸氢根离子 |
HSO 4 − |
硫酸氢盐 |
亚硫酸根离子 |
SO 3 2− |
亚硫酸盐 |
亚硫酸氢根离子 |
HSO 3 − |
亚硫酸氢盐 |
过硫酸根离子 |
S 2O 8 2− |
过硫酸盐 |
硅酸根离子 |
SiO 4 4− |
硅酸盐 |
偏硅酸根离子 |
SiO 3 2− |
偏硅酸盐 |
铝硅酸根离子 |
AlSiO 4 − |
铝硅酸盐 |
3. 有机酸根离子
名称 |
化学式 |
合称 |
|---|---|---|
乙酸根(醋酸根)离子 |
C 2H 3O 2 − |
乙酸盐 |
甲酸根离子 |
HCO 2 − |
甲酸盐 |
草酸根离子 |
C 2O 4 2− |
草酸盐 |
草酸氢根离子 |
HC 2O 4 − |
草酸氢盐 |
4. 其他阴离子
名称 |
化学式 |
合称 |
|---|---|---|
硫化氢根离子 |
HS − |
硫化氢盐 |
碲离子 |
Te 2− |
碲化物 |
氨基负离子 |
NH 2 − |
氨基盐 |
氰酸根离子 |
OCN − |
氰酸盐 |
硫氰酸根离子 |
SCN − |
硫氰酸盐 |
氰离子 |
CN − |
氰化物 |
常见颜色
名称 |
化学式 |
颜色 |
|---|---|---|
高锰酸根离子 |
MnO 4 - |
紫色 |
锰酸根离子 |
MnO 4 2- |
绿色 |
铬酸根离子 |
CrO 4 2- |
黄色 |
重铬酸根离子 |
Cr 2O 7 2- |
橙色 |
铜离子 |
Cu 2+ |
蓝色 |
亚铜离子 |
Cu + |
红色 |
铁离子 |
Fe 3+ |
褐色 |
亚铁离子 |
Fe 2+ |
淡绿色 |
亚钴离子 |
Co 2+ |
粉红色 |
锰离子 |
Mn 2+ |
淡粉红色 |
溴离子 |
Br - |
淡黄色 |
离子方程式
用实际参加反应的 离子符号表示离子反应的式子。它不仅表示一定物质间的某个反应,而且表示了所有同一类型的离子反应的基本步骤为:
①、写出有关反应的 化学方程式。
②、可溶性的强 电解质(强酸、强碱、可溶性盐)用离子符号表示,其它难溶的物质、 气体、水等仍用分子式表示。微溶的强电解质应看其是否主要以自由离子形式存在,例如,石灰水中的Ca(OH) 2写离子符号,石灰乳中的Ca(OH) 2用分子式表示。
③、删去方程式两边不参加反应的离子。
④、检查式子两边的各种原子的个数及电荷数是否相等。
各种类型的离子方程式可按下列方法书写:
①、珞和反应、盐类的水解反应应直接写离子方程式。例如,氯化铁溶液跟硫氰化钾溶液反应:Fe 3++SCN -[Fe(SCN] 2 + 碳酸钠水解:
②、简单的复分解反应可直接写出离子方程式。注意:当反应物一边或生成物一边有多种物质需用分子式表示时,应当写全,不可遗漏。例如,氢氧化钡与硫酸铵溶液共热:可溶性酸式盐跟强碱的反应比较复杂,应按基本步骤书写,否则易出错误。
③、 氧化还原类型的离子反应应按基本步骤书写,否则会出现多种错误。例如,铁跟氯化铁溶液反应,以下写法是错误的(两边电荷不等):Fe+Fe 3+=2Fe 2+ 应先写出化学方程式: Fe+2FeCl 3=3FeCl 2 再删去未反应的Cl -:
Fe+2Fe 3+=3Fe 2+
离子液体的毒性
离子液体(ILs)是完全由离子组成的在室温或使用温度下呈液态的盐,一般由较大的有机阳离子和较小的无机阴离子组成。离子液体的物化性质以及应用方面已有较多报道,但有关离子液体的负面影响直到最近才引起人们的注意。有报道指出:离子液体因没有蒸气压,在使用过程中本身不会形成挥发性有机物而被称为“绿色产品”,但离子液体本身并非“绿色”产品———某些离子液体甚至是有毒的。Jastorff等则指出离子液体在设计应用方面存在一定的危害,并提出应结合多学科知识对其潜在危害性进行综合评价。从离子液体的制备、再生和处置过程看:用于制备离子液体的主要原料(烷基取代咪唑、烷基取代吡啶、烷基取代盐和烷基取代铵盐等)大多是挥发性有机物;而离子液体的再生过程主要是采用具有挥发性的传统有机溶剂进行萃取的过程;某些离子液体本身是有毒且难以生物降解的。因此,在离子液体大规模应用前需对其应用风险进行评价 [1] 。
离子液体的毒性在其对生态环境的影响与应用风险评价方面起着极其重要的作用。近年来有关离子液体毒性方面的研究却远远滞后于离子液体物性及应用研究,直到最近才有少量报道 [1] 。
离子液体的毒性研究
离子液体毒性的相关研究,国外处于起步阶段,国内尚未见相关报道。从已有研究报道看,研究工作主要集中在以下两个问题:一是ILs对生态系统中各类生物的毒性作用情况;二是ILs的各部分组成对ILs毒性的影响。ILs各组成部分对其毒性的影响主要包括如下方面: (1)阳离子核对ILs毒性的影响;(2)侧链取代基R1、R2的长度对ILs毒性的影响;(3)阴离子对ILs毒性的影响。研究方法以生物个体水平的毒性试验研究为主,并有少量分子、细胞水平的毒性试验以及SAR研究 [1] 。

-
离子减薄仪及处理附件
2025-09-23 13:00:15 查看详情


 求购
求购









