- 氮气

氮气
发现历史
 拉瓦锡瑞典化学家卡尔·谢勒(Carl Scheele)和苏格兰植物学家丹尼尔·卢瑟福(Daniel Rutherford)在1772年分部发现了氮。牧师卡文迪许和拉瓦锡也在差不多的同一时间独立地获得了氮。氮气首先被拉瓦锡(Lavoisier)认可为元素,他将其命名为“偶氮”,意思是“无生命”。查普塔尔在1790年将该元素命名为氮。该名称源自希腊语“nitre”(硝酸盐中含氮的硝酸盐)。[2]
拉瓦锡瑞典化学家卡尔·谢勒(Carl Scheele)和苏格兰植物学家丹尼尔·卢瑟福(Daniel Rutherford)在1772年分部发现了氮。牧师卡文迪许和拉瓦锡也在差不多的同一时间独立地获得了氮。氮气首先被拉瓦锡(Lavoisier)认可为元素,他将其命名为“偶氮”,意思是“无生命”。查普塔尔在1790年将该元素命名为氮。该名称源自希腊语“nitre”(硝酸盐中含氮的硝酸盐)。[2]
理化性质
大气中约有4,000万亿吨气体,其中氮气占78%。氮气微溶于水和酒精。它是不可燃的,被认为是一种窒息性气体(即,呼吸纯净的氮气会剥夺人体的氧气)。尽管氮被认为是一种惰性元素,但它会形成一些非常活跃的化合物。它可用作稀释剂并控制自然的燃烧和呼吸速率,在较高的氧气浓度下会更快。氮可溶于水和酒精,但基本上不溶于大多数其他液体。它在生活中是必不可少的,其化合物可用作食物或肥料。氮用于制造氨和硝酸。氮气在环境温度和中等温度下基本上是惰性气体。因此,大多数金属都容易处理它。在升高的温度下,氮可能对金属和合金具有侵蚀性。[2]
来源
氮是地球上第30大最丰富的元素。考虑到氮气占大气量的4/5,即占大气的78%以上,我们几乎可以使用无限量的氮气。氮也以硝酸盐形式存在于多种矿物质中,例如智利硝石(硝酸钠),硝石或硝石(硝酸钾)和含有铵盐的矿物质。氮存在于许多复杂的有机分子中,包括存在于所有活生物体中的蛋白质和氨基酸。[2]
制备
实验室方法
实验室最常用的是亚硝酸铵的分解,实际上是将亚硝酸钠饱和溶液慢慢加到热的饱和氯化铵溶液中:。[3]
液态空气分馏法
氮气主要是从大气中分离或含氮化合物的分解制得的。[3]每年通过液化空气生产超过3,300万吨的氮气,然后使用分馏的方法在大气中生产氮气以及其他气体。[2]
深冷分离法
深冷分离法又称为低温精馏法,利用空气中氮气与氧气的沸点不一致来分离氧气和氮气。由于氮气的沸点(-196℃) 低于氧气(-183℃),在液态空气的蒸发过程中,液氮比液氧更容易变成气态,而在空气液化过程中,氧气比氮气更容易变成液态。由于氮气与氧气的沸点相差不大,液态空气与气态空气需经过反复多次的蒸发、冷凝、再蒸发过程(该过程称为低温精馏过程),最终在精留塔顶部气相馏分中就可以过得较高高纯度的氮气,氮气的纯度取决于精馏塔的塔板级数和精馏效率。[4]
深冷分离法工艺已经历了 100 多年的发展,先后经历了高压、高低压、中压和全低压流程等多种不同的工艺流程。随着现代空分工艺技术和设备的发展,高压、高低压、中压空分流程已基本被淘汰,能耗更低、生产更安全的全低压流程已成为大中型低温空分装置的首选。全低压空分工艺根据氧氮产品压缩环节不同,又分为外压缩流程和内压缩流程。全低压外压缩流程生产出低压氧气或氮气,然后经外置的压缩机将产品气体压缩至所需压力供给用户。全低压内压缩流程将精馏产生的液态氧或液态氮在冷箱内通过液体泵加压至用户所需压力后汽化,并在主换热器内复热后供给用户。主要工艺过程为原料空气过滤、压缩、冷却、纯化、增压、膨胀、精馏、分离、复热、外供。[4]
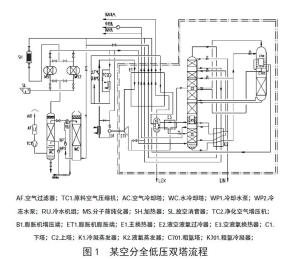 图片引自[4]。
图片引自[4]。
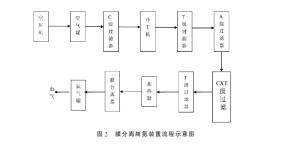
膜分离法
膜分离技术是基于薄膜对气体组分具有选择性渗透和扩散的特性,以达到气体分离和纯化的目的。气体中各种组分透过膜的速度不同,每种组分透过膜的速度与该气体的性质、膜的特性和膜两面的分压差有关。透过膜的气体组分不可能达到 100%的纯度。气体分离膜通常可分为多孔材质和非多孔材质,它们无机物(多孔玻璃、陶瓷、金属、电子导电性固体和钯合金等)或有机高分子(微孔聚乙烯、多孔醋酸纤维、均质醋酸纤维、聚硅氧烷橡胶和聚碳酸脂)组成。[5]
净化后的压缩空气经过缓冲罐,联合过滤器后由膜组一端进入,气体分子在压力作用下首先在膜的高压侧接触。混合气体在膜的高压侧表面以不同的溶解度溶于膜内,然后在膜两侧压力差的推动下,混合气体的分子以不同的速度向膜的低压侧扩散。经过溶解和扩散两个过程的选择,最终混合气体被分离成各个组分。例如:空气、氧气的透过速度大于氮气,经过膜分离之后,高压侧留下的气体富氮,而透过去的气体富氧。[5]
图片引自[5]。
变压吸附法PSA法
该方法是以压缩空气为原料,一般以分子筛为吸附剂,在一定的压力下,利用空气中氧气和氮气分子在不同分子筛表面吸附量的差异,在一定时间内氧在吸附相富集, 氮在气体相富集,实现氧、氮分离;而卸压后分子筛吸附剂解析再生,循环使用。[4]吸附剂除了分子筛之外,还可应用活性氧化铝、硅胶等。[5]
目前, 常用变压吸附制氮装置是以压缩空气为原料,碳分子筛为吸附剂,利用氧和氮在碳分子筛上的吸附容量、吸附速率、吸附力等方面的差异及分子筛对氧和氮随压力不同具有不同的吸附容量的特性来实现氧、氮分离。首先,空气中的氧被碳分子筛优先吸附,从而在气相中富集氮气。为连续获得氮气,需两个吸附塔交替工作。[5]
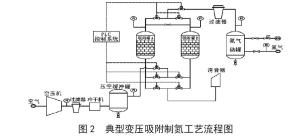 图片引自[4]。
图片引自[4]。
相关反应
合成氨反应
工业上的氨气是由氢气和氮气直接合成的:N2(g)+3H2(g)=2NH3(g)(反应条件为高温高压、催化剂)。氨气的合成是一个体积缩小的放热反应,增大体系压强和降低体系温度对合成反应有利。[6]
分解反应
实验室中常用来制取氮气的方法是加热亚硝酸钠和氯化铵的饱和溶液,具体反应为:NH4Cl+NaNO2=NH4NO2+NaCl,NH4NO2=N2↑+2H2O。[6]
燃烧反应
氨气在空气中很难燃烧,但在纯氧中可以燃烧生成氮气:4NH3+3O2=2N2↑+6H2O。[6]
常温下氮气难以与氧气反应,但在放电或者高温的条件下,可以与氧气反应:N2+O2=2NO。闪电能够使空气里的氮气转化为一氧化氮,是一种自然固氮。[7]
与活泼金属反应
氮气在加热条件下可以与金属发生反应,以镁为例:N2+Mg→Mg3N2(反应条件为加热)。[7]
氮气用途
氮气通常被称为惰性气体,用于某些惰性气氛中以进行金属处理,并用于灯泡中以防止产生电弧,但它不是化学惰性的。它是动植物生命中必不可少的元素,并且是许多有用化合物的组成部分。氮与许多金属结合形成硬氮化物,可用作耐磨金属。钢中的少量氮会抑制高温下的晶粒生长,并且还会提高某些钢的强度。它也可用于在钢上产生坚硬的表面。氮气可用于制造氨,硝酸,硝酸盐,氰化物等;在制造炸药中;填充高温温度计,白炽灯泡;形成惰性材料以保存材料,用于干燥箱或手套袋中。食品冷冻过程中的液氮;在实验室中作为冷却剂。[2]
 图片引自[2]。
图片引自[2]。
注意事项与安全
| 类别 | 有害气体 |
| 爆炸物危险特性 | 钢瓶高热可爆 |
| 可燃物危险特性 | 不燃;无毒;可令人窒息 |
| 储运特性 | 库房通风低温干燥;轻装轻卸 |
| 灭火剂 | 水 |
| 危险品运输编号 | UN 1066 2.2 |
| RTECS号 | QW9700000 |
| HazardClass | 2.2 |
| 毒害物质数据 | 7727-37-9(Hazardous Substances Data) |
词条图册
| 类别 | 有害气体 |
| 爆炸物危险特性 | 钢瓶高热可爆 |
| 可燃物危险特性 | 不燃;无毒;可令人窒息 |
| 储运特性 | 库房通风低温干燥;轻装轻卸 |
| 灭火剂 | 水 |
| 危险品运输编号 | UN 1066 2.2 |
| RTECS号 | QW9700000 |
| HazardClass | 2.2 |
| 毒害物质数据 | 7727-37-9(Hazardous Substances Data) |



 求购
求购








