- 亚硝酸

亚硝酸
理化性质
物理性质
外观与性状:无色液体。
气味:有刺激性气味。
密度:未知。
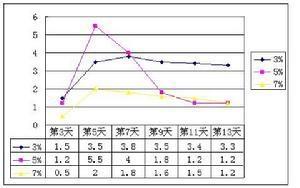 亚硝酸熔沸点:未知。
亚硝酸熔沸点:未知。
分子量:47.013
键长:N—OH为143pm,N—O为118pm。
键角:HON为102°,∠ONO为111°。
化学性质
亚硝酸盐除黄色的AgNO2不溶于水外,大多数亚硝酸盐是无色的,一般易溶于水。
氧化性
2HNO2+2I-+2H+====I2+2NO↑+2H2O
这个反应可用于分析测定。在多数的情况下,亚硝酸可还原成一氧化氮NO,也可还原成氧化二氮N2O、氮、羟氨NH2OH或氨NH3。它被氧化时,即成为硝酸。 将二氧化氮和一氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液:
NO2+NO+H2O====2HNO2
在亚硝酸盐溶液中加入酸,也可得到亚硝酸的溶液:
NaNO2+HCl─→HNO2+NaCl
亚硝酸也可用NO与O2与水反应制得:
4NO+O2+2H2O===4HNO2
此反应可以理解为NO与O2生成N2O3,N2O3再与水反应形成亚硝酸。
分解产物
硝酸盐分解的产物可以是:
1、亚硝酸盐和氧气(碱金属和碱土金属的硝酸盐);
2、金属氧化物和氮氧化物(镁和铜之间的硝酸盐);
3、金属单质(铜后金属硝酸盐)。
亚硝酸氧化性强于硝酸,这是因为3价氮不稳定,易分解释放出氧原子的原因。
其它:脂肪伯胺与亚硝酸反应生成相应的醇,并放出氮气。 芳香伯胺与亚硝酸在低温和酸性条件下发生重氮化反应,产物重氮盐不稳定,遇热分解成为酚与氮气。 脂肪仲胺和芳香仲胺与亚硝酸反应生成N-亚硝基胺,其是不溶于水的黄色油状物或固体。 脂肪叔胺和亚硝酸只形成不稳定的盐。 芳香叔胺如N,N-二甲苯胺在酸性条件下可与亚硝酸反应生成4-亚硝基-N,N-二甲苯胺,其为绿色沉淀。亚硝酸盐是一种食品防腐剂,能防止食品腐败
变质,具有显著的杀菌或抑菌效能,特别是在腌肉工业上得到广泛应用[2]。
制备方法
制备环节
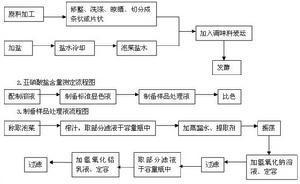 亚硝酸用亚硝酸钠制取。 化学式NaNO2。亚硝酸仅存在于稀的水溶液中,是一种弱酸,不稳定,易分解成NO2和NO,也能发生如下歧化反应:3HNO2====HNO3+2NO↑+H2O
亚硝酸用亚硝酸钠制取。 化学式NaNO2。亚硝酸仅存在于稀的水溶液中,是一种弱酸,不稳定,易分解成NO2和NO,也能发生如下歧化反应:3HNO2====HNO3+2NO↑+H2O
在亚硝酸中氮原子的氧化数是+3,是一种中间氧化态,因此,亚硝酸既具有氧化性,又具有还原性,而氧化性比还原性更为突出。例如,它在水溶液中能将I-离子氧化为单质碘:
将二氧化氮和氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液:
NO2+NO+H2O====2HNO2
在亚硝酸盐溶液中加入酸,也可得到亚硝酸的溶液:
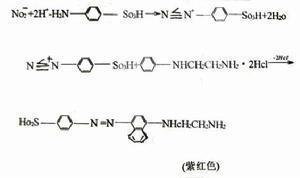 亚硝酸NaNO2+HCl====HNO2+NaCl
亚硝酸NaNO2+HCl====HNO2+NaCl
亚硝酸在工业上用于有机合成,使胺类转变成重氮化合物,从而制备偶氮染料。
亚硝酸有顺式和反式之分,其中反式亚硝酸比顺式亚硝酸更稳定。
检验环节
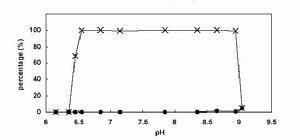 亚硝酸亚硝酸根离子可在酸性介质中,通过和铁(II)反应产生棕色环加以定性检出。参见棕色环实验。
亚硝酸亚硝酸根离子可在酸性介质中,通过和铁(II)反应产生棕色环加以定性检出。参见棕色环实验。
Fe2++ NO2-+ 2H+= Fe3++NO↑ + H2O
Fe2++SO42-+ NO = [Fe(NO)]SO4
生成棕色的硫酸亚硝酰铁(I) (当酸为醋酸时会反应)



 求购
求购








