- 四氧化氙
四氧化氙
基本性质
英文名 xenon tetraoxide
xenon(VIII) oxide
其它名称 氧化氙(VIII)
性质
化学式 XeO4
摩尔质量 195.29 g mol-1
外观 −36°C以下为黄色 固体
熔点 −35.9 °C
沸点 0 °C 分解
在水中的
溶解度 可溶
危险性 爆炸性
简介:
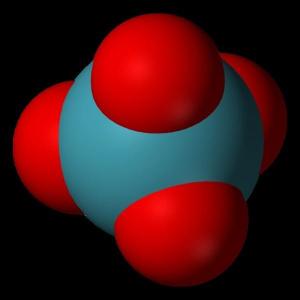 四氧化氙(化学式:XeO4)是稀有气体氙的氧化物之一,无色气体,热稳定性极差,易爆炸。低温下是黄色固体,也极不稳定,甚至在-40℃也会发生爆炸。溶于水生成 高氙酸,溶于碱生成高氙酸盐。四氧化氙只在-35.9°C以下稳定,高于该温度时爆炸性分解为氙和 氧气。
四氧化氙(化学式:XeO4)是稀有气体氙的氧化物之一,无色气体,热稳定性极差,易爆炸。低温下是黄色固体,也极不稳定,甚至在-40℃也会发生爆炸。溶于水生成 高氙酸,溶于碱生成高氙酸盐。四氧化氙只在-35.9°C以下稳定,高于该温度时爆炸性分解为氙和 氧气。
氧化性比 三氧化氙更强。由高氙酸钠与 浓硫酸反应制得。用作 氧化剂。
结构
分子构型为四面体。四氧化氙中,氙原子的氧化态为+8,所有的价电子都用于成键。其他的氙氧化物包括三氧化氙,二氧化氙以及存在于固态氩中的XeOO+阳离子。
 结构式
结构式
反应
四氧化氙在高于−35.9°C时自发分解为氙和氧气:
XeO4 = Xe + 2 O2; ΔH = -643 kJ/mol
其他含+8氧化态的氙的化合物是XeO3F2和XeO2F4,可被质谱检测到,由四氧化氙与六氟化氙反应得到。
合成
四氧化氙的所有合成路线都以高氙酸盐作起始原料。高氙酸盐可由氙酸盐的歧化反应或用臭氧氧化氙酸盐得到:
2 XeO4 ^2− = XeO64− + Xe + O2
2 XeO4^2− + 4 e- + 2 O3 →=2 XeO6^4- + 2 O2
高氙酸盐与硫酸反应生成不稳定的高氙酸。高氙酸脱水得到四氧化氙:
Ba2XeO6 + 2 H2SO4 ==2 BaSO4 + (H4XeO6 = 2 H2O + XeO4)
高氙酸缓慢分解歧化生成氙酸和氧气:
H4XeO6 = 1/2 O2 + H2XeO4 + H2O

-
氧化锌避雷器带电测试仪
2025-09-21 15:07:39 查看详情 -
氧化锌避雷器特性测试仪
2025-09-21 15:07:39 查看详情 -
二氧化碳气体保护焊机
2025-09-21 15:07:39 查看详情 -
汽车二氧化锆式氧传感器
2025-09-21 15:07:39 查看详情


 求购
求购







