- 克拉珀龙方程

克拉珀龙方程
推导
pV=nRT
推导该公式建立在Boyle-Marriote定律,Charles-Gay-Lussac定律,Avogadro定律基础上
V=f(p,T,N)
求V全微分
将Boyle-Marriote定律,以及Charles-Gay-Lussac定律代入全微分中
不定积分得到lnV+lnp=lnT+C
令C=lnR
即得pVm=RT
同乘以n得到pV=nRT
注:所有气体R值均相同。
![]() 如果压强、温度和体积都采用国际单位(SI),则P表示压强,单位Pa;V表示气体体积,单位立方米;n表示物质的量,单位mol;T表示热力学温度,单位K(开尔文);R表示气体常数,单位J·mol^-1·K^-1或kPa·L·K^-1·mol^-1。R=8.314帕米3/摩尔·K。
如果压强、温度和体积都采用国际单位(SI),则P表示压强,单位Pa;V表示气体体积,单位立方米;n表示物质的量,单位mol;T表示热力学温度,单位K(开尔文);R表示气体常数,单位J·mol^-1·K^-1或kPa·L·K^-1·mol^-1。R=8.314帕米3/摩尔·K。
因为n=m/M、ρ=m/v(n—物质的量,m—物质的质量,M—物质的摩尔质量,数值上等于物质的分子量,ρ—气态物质的密度),所以克拉伯龙方程式也可写成以下两种形式:
Pv=m/MRT ……②
PM=ρRT ……③
以A、B两种气体来进行讨论。
(1)在相同T、P、V时:
根据①式:nA=nB(即阿伏加德罗定律)
(2)在相同T·P时: 摩尔质量之比=分子量之比=密度之比=相对密度)。若mA=mB则MA=MB。
体积之比=摩尔质量的反比;两气体的物质的量之比=摩尔质量的反比)
物质的量之比=气体密度的反比;两气体的体积之比=气体密度的反比)。
(3)在相同T·V时:
摩尔质量的反比;两气体的压强之比=气体分子量的反比)。
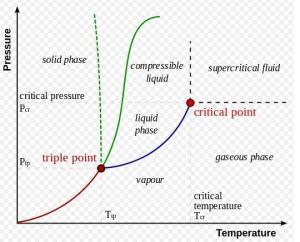 典型的相图,途中的界限即为相平衡线 典型的相图,途中的界限即为相平衡线 |
阿伏加德罗定律推论
 典型的相图,途中的界限即为相平衡线 典型的相图,途中的界限即为相平衡线 |
相对密度
我们可以利用阿伏加德罗定律以及物质的量与分子数目、摩尔质量之间的关系得到以下有用的推论:
(1)同温同压时:①V1:V2=n1:n2=N1:N2
②ρ1:ρ2=M1:M2
③ 同质量时:V1:V2=M2:M1
(2)同温同体积时: ④ p1:p2=n1:n2=N1:N2
⑤ 同质量时: p1:p2=M2:M1
(3)同温同压同体积时: ⑥ ρ1:ρ2=M1:M2=m1:m2
具体的推导过程请大家自己推导一下,以帮助记忆。推理过程简述如下:
(1)、同温同压下,体积相同的气体就含有相同数目的分子,因此可知:在同温同压下,气体体积与分子数目成正比,也就是与它们的物质的量成正比,即对任意气体都有V=kn;因此有V1:V2=n1:n2=N1:N2,再根据n=m/M就有式②;若这时气体质量再相同就有式③了。
(2)、从阿伏加德罗定律可知:温度、体积、气体分子数目都相同时,压强也相同,亦即同温同体积下气体压强与分子数目成正比。其余推导同(1)。
(3)、同温同压同体积下,气体的物质的量必同,根据n=m/M和ρ=m/V就有式⑥。当然这些结论不仅仅只适用于两种气体,还适用于多种气体。
 克拉珀龙方程
克拉珀龙方程
理想气体方程和克拉伯龙方程
在同温同压下,像在上面结论式②和式⑥中出现的密度比值称为气体的相对密度D=ρ1:ρ2=M1:M2。
注意:
①D称为气体1相对于气体2的相对密度,没有单位。如氧气对氢气的密度为16。
②.若同时体积也相同,则还等于质量之比,即D=m1:m2。
词条图册
值得注意的是,把理想气体方程和克拉伯龙方程等效是不正确的。一般克拉伯龙方程是指描述相平衡的方程dp/dT=L/(TΔV)。尽管理想气体定律是由克拉伯龙发现,但是国际上不把理想气体状态方程叫克拉伯龙方程。

-
非线性方程组数值解法
2025-09-21 04:47:01 查看详情 -
F1方程赛车逆向设计
2025-09-21 04:47:01 查看详情 -
三款小排量小型SUV雪铁龙C3 1.8L车型的油耗方程式
2025-09-21 04:47:01 查看详情 -
成都车展:一汽奔腾无限方程架构发布/第三代B70将问世 e
2025-09-21 04:47:01 查看详情 -
雪铁龙C3 1.8L车型的油耗方程式
2025-09-21 04:47:01 查看详情 -
东风雪铁龙凡尔赛C5 1.8L车型的油耗方程式
2025-09-21 04:47:01 查看详情 -
雪铁龙天逸对比大众途岳 1.8L车型的油耗方程式
2025-09-21 04:47:01 查看详情


 求购
求购





