- 电子亲和能

电子亲和能
基本概念
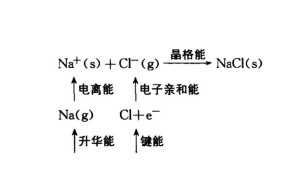 电子亲和能元素的一个基态的气态原子得到一个电子形成- 1 价气态 阴离子时所放出的能量称为该元素的第一电子亲和能,用E 1表示。从 - 1价的气态阴离子再得到1 个电子,成 为 -2价的气态阴离子所放出的能量称为第二电子亲和能E2,依此类推。元素原子的第一电子亲和能一般都 是负值,因为电子落入中性原子的核场里势能降低,体系能量减少。唯稀有气体原子和 II A族原子最外电子亚层已全充满,要加合一个电子,环境必须对体系 做功,亦即体系吸收能量才能实现,所以第一电子亲和能为正值。所有元素原子的第二电 子亲和能都为正值,因为阴离子本身是个负电场,对外加电子有排斥作用,要再加合电子 时,环境也必须对体系做功。目前己知道的元素的电子亲和能数据较少,测定的准确性也较差。[2]
电子亲和能元素的一个基态的气态原子得到一个电子形成- 1 价气态 阴离子时所放出的能量称为该元素的第一电子亲和能,用E 1表示。从 - 1价的气态阴离子再得到1 个电子,成 为 -2价的气态阴离子所放出的能量称为第二电子亲和能E2,依此类推。元素原子的第一电子亲和能一般都 是负值,因为电子落入中性原子的核场里势能降低,体系能量减少。唯稀有气体原子和 II A族原子最外电子亚层已全充满,要加合一个电子,环境必须对体系 做功,亦即体系吸收能量才能实现,所以第一电子亲和能为正值。所有元素原子的第二电 子亲和能都为正值,因为阴离子本身是个负电场,对外加电子有排斥作用,要再加合电子 时,环境也必须对体系做功。目前己知道的元素的电子亲和能数据较少,测定的准确性也较差。[2]
意义
显然,元素的电子亲和能反映了元素的原子得到电子的难易程度。元素原子的电子亲和能越大.引力越强,也就是越容易得到电子。[3]
变化规律
一般来说,电子亲和能的代数值随原子半径的增大而减小,即在同一族中由上向下减小, 而在同一周期中由左到右增大。但应该注意的是,VIA和VIIA 电子亲和能绝对值最大的 并不是每族的第一种元素,而是第二种元素。这一反常现象可以解释为:第二周期的氧和 氟的原子半径较小,电子密度大,电子间的排斥力强,以致当原子结合1 个电子形成负离 子时,放出的能量较小,而第二种元素硫和氯的半径较大,且同一层中有空的d 轨道可容 纳电子,电子的排斥力小,因此形成负离子时放出的能量最大。[4]
元素亲和能数据
以下为元素的电子亲和能数据,仅作参考。[4]元素电子亲和能(KJ/mol)
氢
72.77
锂
59.62
硼
26.99
碳
121.78
氧
141.004
氟
328.165
钠
52.87
铝
41.86
硅
134.07
磷
72.03
硫
200.410
氯
349
钾
48.38
钙
2.37
钪
18(2)
钛
8.4(7)
钒
51
铬
65.2
铁
14.6(3)
钴
64.0
镍
111.6
铜
119.24
镓
41(3)
锗
118.94
砷
78.5(7)
硒
194.97
溴
342.54
铷
46.89
锶
5.02
钇
30
锆
41
铌
86(2)
钼
72.3
钌
101.0
铑
110.3
钯
54.24
银
125.86
铟
39
锡
107.30
锑
101.06
碲
190.16
碘
295
铯
45.51
钡
13.95
镧
45(2)
铈
92(2)
铥
99(2)
镏
33
钽
31
钨
79
锇
104.0
铱
150.9
铂
205.04
金
222.75
铊
36
铅
35
铋
90.92
分子的电子亲合能
电子亲合能的定义也可以延伸到分子。如苯和萘的电子亲合能为负值,而蒽 、菲、芘的电子亲合能为正值。电脑模拟实验证实 hexacyanobenzene C6(CN)6 的电子亲合能较富勒烯要高。[4]
| 分子 | 电子亲和能(KJ/mol) |
|---|---|
| 双原子分子 | |
| 溴 | 244 |
| 氯 | 227 |
| 氟 | 297 |
| 碘 | 246 |
| 氧 | 43 |
| 溴化碘 | 251 |
| 氯化锂 | 59 |
| 一氧化氮 | 2 |
| 三原子分子 | |
| 二氧化氮 | 222 |
| 二氧化硫 | 105 |
| 多原子分子 | |
| 苯 | −110 |
| 1,4-苯二酮 | 129 |
| 三氟化硼 | 255 |
| 硝酸 | 59 |
| 硝基甲烷 | 38 |
| 三氯化磷 | 134 |
| 六氟化硫 | 138 |
| 四氰乙烯 | 278 |
| 六氟化钨 | 264 |
| 六氟化铀 | 280 |
词条图册
| 分子 | 电子亲和能(KJ/mol) |
|---|---|
| 双原子分子 | |
| 溴 | 244 |
| 氯 | 227 |
| 氟 | 297 |
| 碘 | 246 |
| 氧 | 43 |
| 溴化碘 | 251 |
| 氯化锂 | 59 |
| 一氧化氮 | 2 |
| 三原子分子 | |
| 二氧化氮 | 222 |
| 二氧化硫 | 105 |
| 多原子分子 | |
| 苯 | −110 |
| 1,4-苯二酮 | 129 |
| 三氟化硼 | 255 |
| 硝酸 | 59 |
| 硝基甲烷 | 38 |
| 三氯化磷 | 134 |
| 六氟化硫 | 138 |
| 四氰乙烯 | 278 |
| 六氟化钨 | 264 |
| 六氟化铀 | 280 |

-
华中科技大学光学与电子信息学院
2025-11-02 12:23:20 查看详情 -
电子科技大学(沙河校区)
2025-11-02 12:23:20 查看详情 -
Jin Air Green Wings电子竞技俱乐部
2025-11-02 12:23:20 查看详情 -
杭州电子信息职业学校
2025-11-02 12:23:20 查看详情 -
云南师范大学物理与电子信息学院
2025-11-02 12:23:20 查看详情


 求购
求购









