- 氦

氦
研究历史
 威廉·拉姆塞1868年8月18日,法国天文学家让桑赴印度观察日全食,利用分光镜观察日珥,从黑色月盘背面突出的红色火焰,看见有彩色的彩条,是太阳喷射出来的炽热的光谱。他发现一条黄色谱线,接近钠光谱总的D1和D2线。日蚀后,他同样在太阳光谱中观察到这条黄线,称为D3线。1868年10月20日,英国天文学家洛克耶也发现了这样的一条黄线。
威廉·拉姆塞1868年8月18日,法国天文学家让桑赴印度观察日全食,利用分光镜观察日珥,从黑色月盘背面突出的红色火焰,看见有彩色的彩条,是太阳喷射出来的炽热的光谱。他发现一条黄色谱线,接近钠光谱总的D1和D2线。日蚀后,他同样在太阳光谱中观察到这条黄线,称为D3线。1868年10月20日,英国天文学家洛克耶也发现了这样的一条黄线。
经过进一步研究,认识到是一条不属于任何已知元素的新线,是因一种新的元素产生的,把这个新元素命名为 helium,来自希腊文helios(太阳),元素符号定为He。这是第一个在地球以外,在宇宙中发现的元素。为了纪念这件事,当时铸造一块金质纪念牌,一面雕刻着驾着四匹马战车的传说中的太阳神阿波罗(Apollo)像,另一面雕刻着詹森和洛克耶的头像,下面写着:1868年8月18日太阳突出物分析。在詹逊从太阳光谱中发现氦时,英人J. N. Lockyer和E. F. Frankland认为这种物质在地球上还没有发现,因此定名为“氦”(法文为hélium,英文为helium),源自希腊语ήλιος,意为“太阳”。
过了20多年后,拉姆赛在研究钇铀矿时发现了一种神秘的气体。由于他研究了这种气体的光谱,发现可能是詹森和洛克耶发现的那条黄线D3线。但由于他没有仪器测定谱线在光谱中的位置,他只有求助于当时最优秀的光谱学家之一的伦敦物理学家克鲁克斯。克鲁克斯证明了,这种气体就是氦。这样氦在地球上也被发现了。
在二十世纪初的几十年里,世界各国都在寻找氦气资源,在当时主要是为了充飞艇。但是到了二十一世纪,氦不仅用在飞行上,尖端科学研究,现代化工业技术,都离不开氦,而且用的常常是液态的氦,而不是气态的氦。液态氦把人们引到一个新的领域——低温世界。
英国物理学家杜瓦(Dewar)在1898年首先得到了液态氢。就在同一年,荷兰的物理学家卡美林·奥涅斯也得到了液态氢。液态氢的沸点是零下253℃,在这样低的温度下,其他各种气体不仅变成液体,而且都变成了固体。只有氦是最后一个不肯变成液体的气体。包括杜瓦和卡美林·奥涅斯在内的科学家们和决心把氦气也变成液体。
1908年7月13日晚,荷兰物理学家卡美林·奥涅斯(Heike Kamerlingh Onnes昂纳斯)和他的助手们在著名的莱顿实验室取得成功,氦气变成了液体。他第一次得到了320立方厘米的液态氦。
要得到液态氦,必须先把氦气压缩并且冷却到液态空气的温度,然后让它膨胀,使温度进一步下降,氦气就变成了液体。液态氦是一种与众不同的液体,其沸点为零下269℃。在这样低的温度下,氢也变成了固体,与空气接触时,空气会立刻在液态氦的表面上冻结成一层坚硬的盖子。
1934年,在英国卢瑟福那里学习的前苏联科学家卡比查发明了新型的液氦机,每小时可以制造4升液态氦。以后,液态氦才在各国的实验室中得到广泛的研究和应用。
含量分布
氦存在于整个宇宙中,按质量计占23%,仅次于氢。但在自然界中主要存在于天然气体或放射性矿石中。在地球的大气层中,氦的浓度十分低,只有5.2万分之一。在地球上的放射性矿物中所含有的氦是α衰变的产物。氦在某些天然气中含有在经济上值得提取的量,最高可以含有7%,在美国的天然气中氦大约有1%,在地表的空气中每立方米含有4.6立方厘米的氦,大约占整个体积的0.0005%,密度只有空气的7.2分之一,是除了氢以外密度最小的气体。
| 地壳中含量 | 0.008(ppm) |
| 元素在太阳中的含量 | 230000(ppm) |
| 元素在海水中的含量 | 0.000006(ppm) |
地球上的氦主要是放射性元素衰变的产物,α粒子就是氦的原子核。在工业中可由含氦达7%的天然气中提取。也可由液态空气中用分馏法从氦氖混合气体中制得。
物理性质
| 地壳中含量 | 0.008(ppm) |
| 元素在太阳中的含量 | 230000(ppm) |
| 元素在海水中的含量 | 0.000006(ppm) |
基本信息
超流动性
![]() 氦的原子光谱
氦的原子光谱
元素符号He,原子序数2,原子量4.002602(氦4),为稀有气体的一种。元素名来源于希腊文,原意是“太阳”。
 通电发光后的氦气氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上是氦4。相对原子质量为4.003。1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。氦在空气中的含量为0.0005%。
通电发光后的氦气氦有两种天然同位素:氦3、氦4,自然界中存在的氦基本上是氦4。相对原子质量为4.003。1868年有人利用分光镜观察太阳表面,发现一条新的黄色谱线,并认为是属于太阳上的某个未知元素,故名氦。氦在空气中的含量为0.0005%。
氦在通常情况下为无色、无味的气体;熔点-272.2℃(25个大气压),沸点-268.9℃;密度0.1785克/升,临界温度-267.8℃,临界压力2.26大气压;水中溶解度8.61厘米³/千克水。
氦是惰性元素之一,分子式为He,是一种稀有气体,无色、无臭、无味。它在水中的溶解度是已知气体中最小的,也是除氢气以外密度最小的气体。密度0.17847克/升,熔点-272.2℃(25个大气压)。沸点-268.9℃。它是最难液化的一种气体,其临界温度为-267.9℃。临界压力为2.25大气压。当液化后温度降到-270.98℃以下时,具有表面张力很小,导热性很强,几乎不呈现任何粘滞性。液体氦可以用来得到接近绝对零度(-273.15℃)的低温。化学性质十分不活泼,既不能燃烧,也不能助燃。氦也是最难液化的气体。
氦在通常情况下为无色、无味的气体。是唯一不能在标准大气压下固化的物质。液态氦在温度下降至2.18K时,性质发生突变,成为一种超流体,能沿容器壁向上流动,热传导性为铜的800倍,并变成超导体;其比热容、表面张力、压缩性都是反常的。
由于液氦的超低温,在此温度下出现了许多奇妙的物理现象。许多重要的物理实验,都要在低温下进行。世界各国的物理学家都在研究液态氦,希望通过液态氦达到更低的温度,研究各种物质在低温下会发生什么变化,会有什么我们还不知道的性质。这就产生了物理学的一个新的分支——低温物理学。
| 熔点 | -272.2℃(25个大气压); |
| 沸点 | -268.9℃; |
| 密度 | 0.1785克/升 |
| 临界温度 | -267.8℃ |
| 临界压力 | 2.26大气压 |
| 水中溶解度 | 8.61立方厘米/千克水 |
| 热导率 | 151.3W/(m·K) |
| 晶体结构 | 晶胞为六方晶胞 |
氦-4
下表为液氦(氦4)的一些基本物理性质(某些参数测定时的状态不详):
| 正常沸点/K | 4.224 |
| 密度/kg/m³ | 124 96 |
| 蒸发热/kJ/kg | 20.73 |
| 比热/kJ/(kg·K) | 4.56 |
| 粘度/MPa·s | 3.57 |
| 热导率/mW/(m·K) | 2.72 |
| 介电常数 | 1.0492 |
| 临界温度/K | 5.201 |
| 临界压力/MPa | 0.227 |
氦-3
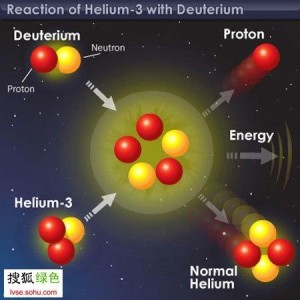 氦-3氦3是自然界中氦的稳定同位素,原子量为3.016,原子核由2个质子和一个中子组成。通常情况下,氦3为无色、无味、无毒、不燃烧的惰性气体,在0℃及0.101325MPa下密度是0.1345kg/m3。
氦-3氦3是自然界中氦的稳定同位素,原子量为3.016,原子核由2个质子和一个中子组成。通常情况下,氦3为无色、无味、无毒、不燃烧的惰性气体,在0℃及0.101325MPa下密度是0.1345kg/m3。
下表为液氦(氦3)的一些基本物理性质:
| 正常沸点/K | 3.191 |
| 密度/kg/m³ | 82.3 |
| 蒸发热/J/mol | 20.56 |
| 1.0K时的比热/J/(mol·K) | 4.222 |
| 3.2K时的粘度/mPa·s | 3.57 |
| 3.2K时的热导率/mW/(m·K) | 20 |
| 临界温度/K | 3.324 |
| 临界压力/MPa | 0.115 |
超导现象
| 熔点 | -272.2℃(25个大气压); |
| 沸点 | -268.9℃; |
| 密度 | 0.1785克/升 |
| 临界温度 | -267.8℃ |
| 临界压力 | 2.26大气压 |
| 水中溶解度 | 8.61立方厘米/千克水 |
| 热导率 | 151.3W/(m·K) |
| 晶体结构 | 晶胞为六方晶胞 |
化学性质
| 正常沸点/K | 4.224 |
| 密度/kg/m³ | 124 96 |
| 蒸发热/kJ/kg | 20.73 |
| 比热/kJ/(kg·K) | 4.56 |
| 粘度/MPa·s | 3.57 |
| 热导率/mW/(m·K) | 2.72 |
| 介电常数 | 1.0492 |
| 临界温度/K | 5.201 |
| 临界压力/MPa | 0.227 |
氟化物制取猜想
| 正常沸点/K | 3.191 |
| 密度/kg/m³ | 82.3 |
| 蒸发热/J/mol | 20.56 |
| 1.0K时的比热/J/(mol·K) | 4.222 |
| 3.2K时的粘度/mPa·s | 3.57 |
| 3.2K时的热导率/mW/(m·K) | 20 |
| 临界温度/K | 3.324 |
| 临界压力/MPa | 0.115 |
离子化合物
卡美林·奥涅斯是第一个得到液氦的科学家。他又将温度进一步降低,试图得到固态氦,却并没有成功(固态氦是1926年基索姆用降低温度和增大压力的方法首先得到的)。
对于一般液体来说,随着温度降低,密度会逐渐增加。卡美林·奥涅斯使液态氦的温度下降,液氦的密度增大了。但是,当温度下降到零下271℃的时候,液态氦突然停止起泡,同时密度也突然减小了。
这是另一种液态氦。卡美林·奥涅斯把前一种冒泡的液态氦叫做氦Ⅰ,而把后一种静止的液态氦叫做氦Ⅱ。
把一个小玻璃杯按在氦Ⅱ中。玻璃杯由空的渐渐装满了。把这个盛着液态氦的小玻璃杯提出来,挂在半空时,玻璃杯底下出现了液氦,不一会,杯中的液态氦就“漏”光了。
氦Ⅱ能够倒流,它会沿着玻璃杯的壁向高处倒流。此现象只能在低温状态下才会发生,名为“超流动性”,具有“超流动性”的氦Ⅱ叫做超流体。
后来,许多科学家研究了这种怪现象,又有了许多新的发现。比如1938年阿兰等人发现的氦刀喷泉。在一根玻璃管里,装着很细的金刚砂,上端接出来一根细的喷嘴。将这玻璃管浸到氦Ⅱ中,用光照玻璃管粗的下部,细喷嘴就会喷出氦Ⅱ的喷泉,光越强喷得越高,可以高达数厘米。
氦Ⅱ喷泉也是超流体的特殊性质。在这个实验中,光能直接变成了机械能。
中性分子
在液氦的温度下,在一个铅环上放置一个铅球。铅球会好像失重而飘浮在环上,与环保持一定距离。在同样的温度下,用细链子系着磁铁,慢慢放到一个金属盘子里去。当磁铁快要碰到盘子的时候,可以观察到,链子松了,磁铁浮在盘子上,若此时轻轻拍打磁铁,它会自行旋转。这种现象只能在低温观察到,高温下不会产生。
这是低温下的超导现象。有些金属在液态氦的温度下,原子核的运动几乎停止,对电子的阻碍变得极小,因此电阻会消失,成为超导体;由于磁力线不可能穿过超导体,于是在超导体与磁体中间形成了较大的磁场,磁场的斥力托住了铅球和磁铁,使它们浮在半空中。这就是迈斯纳效应(Meissner Effect),这一效应可以被利用来制造磁悬浮列车。
氦钠化合物
 元素周期性质
元素周期性质
氦是所有元素中最不活泼的元素,极难形成化合物,这是因为氦的原子核到电子层距离很小,并且达到了稳定结构。它的性质便决定了用途,氦的应用主要是作为保护气体、气冷式核反应堆的工作流体和超低温冷冻剂等等。
2017年2月6日,中国南开大学的王慧田、周向锋团队及其合作者在《Nature Chemistry》上发表了有关在高压条件下合成氦钠化合物——Na2He的论文[1][2],结束了氦元素无化合物的历史,标志着中国在稀有气体化学领域走到了最前沿。
同位素
Pimental等根据HeF₂的电子排布同稳定的HF₂⁻相似,提出了利用核转变制备HeF₂的三种方法。
1.氚的β衰变法
氚经过β衰变后应变成氦。这样,氚的化合物经β衰变后,就有可能成为氦化合物。为了便于进行反应,首先通过氘和氢的同位素交还,将氘固定在KHF₂的固体晶格中。俘集在晶格中的TF₂⁻发生核反应后,便会生成HeF₂。
TF₂⁻ → HeF₂ +β⁻
氘在衰变过程中的反冲能量,不致使新生成的二氟化氦断链。氘衰变的半衰期为12.25年,估计¹⁰Ci的氚,经4~5个月,仅能生成10μmol的HeF₂ .
2.热中子辐照法
用热中子辐照LiF来产生核反应
₃⁶Li + ₀¹n → ₂⁴He + ₁³T
Li(n,α)反应后,生成的氦核同母体晶格中的F-相结合而生成HeF₂.
3.直接用α粒子轰击固态氟来制备HeF₂
由此看来,这三种方法中,以第一种方法制成HeF₂的可能性最大,但至今还没有见到已制成的报告。Malm等认为HeF₂和HF₂⁻的电子排布虽然相似,但HF₂⁻是H⁻同两个F原子相作用而生成化合物,H⁻的电离势仅为0.7eV,而氦的电离势高达25eV,因此对HeF₂是否存在是值得怀疑的。
制取方法
氦合氢离子,化学式为HeH⁺,是一个带正电的离子。它首次发现于1925年,通过质子和氦原子在气相中反应制得。它是已知最强的酸,质子亲和能为177.8 kJ/mol。这种离子也被称为氦氢分子离子。有人认为,这种物质可以存在于自然星际物质中。这是最简单的异核离子,可以与同核的氢分子离子H₂相比较。与H₂不同的是,它有一个永久的键偶极矩,使它更容易表现出光谱特征。
HeH⁺不能在凝聚相中制备,因为这会使它与任何阴离子、分子、原子发生作用。但是,可以用盖斯定律预测它在水溶液中的酸性。
电离过程-360 kJ/mol的自由能变化相当于pKa为-63。
HeH中共价键的长度是0.772Å。
其他氦氢离子已经知道或者在理论上研究。HeH₂,已经被微波光谱观测到,科学家计算出它的亲和能为6 kcal/mol,而HeH₃为0.1 kcal/mol。
作用用途
不同于氦合氢离子,氢和氦构成的中性分子在一般情况下是很不稳定的。但是,它作为一个准分子在激发态是稳定的,于20世纪80年代中期首次在光谱中观测到。
pka:-63(推测),比氟锑酸强得多。
| HHe(g) | → | H(g) | + He(g) | +178 kJ/mol |
| HHe(aq) | → | HHe(g) | +973 kJ/mol | |
| H(g) | → | H(aq) | – 1530 kJ/mol | |
| He(g) | → | He(aq) | +19 kJ/mol | |
| HHe(aq) | → | H(aq) | + He(aq) | – 360 kJ/mol |
即便如此,这些离子或分子仅出现于“瞬间”,或者仅通过计算得出,故它们尚且难以认为是存在的“化合物”。
危险性
| HHe(g) | → | H(g) | + He(g) | +178 kJ/mol |
| HHe(aq) | → | HHe(g) | +973 kJ/mol | |
| H(g) | → | H(aq) | – 1530 kJ/mol | |
| He(g) | → | He(aq) | +19 kJ/mol | |
| HHe(aq) | → | H(aq) | + He(aq) | – 360 kJ/mol |
引起窒息
2017年2月6日,中国南开大学的王慧田、周向锋团队及其合作者在《Nature Chemistry》上发表了有关在高压条件下合成氦钠化合物——Na2He的论文[1][2],结束了氦元素无化合物的历史,标志着中国在稀有气体化学领域走到了最前沿。
此前,研究人员已经找到其他元素与氦进行配对的方法。但一直以来,都没有形成什么能够稳定存在的物质。最常见的例子就是氦与其他元素的范德华力,无需共价键或者离子键就可以存在。在极低的温度下,氦确实可以形成范德华力,但极其微弱,无法长久保持。[1][2]
氦元素坚固的稳定力源于其闭壳层电子组态:其外壳层是完满的状态,没有空间和其他原子通过共用电子进行结合。不过这是地球表面环境中的情况。
作为宇宙中第二丰富的元素,氦在恒星和巨型气体行星的构成中起着重要作用。在外太空或者地球深处的极端条件下,它可能遵循着不同寻常的规律。如今,研究人员刚刚验证这种奇异的现象。
犹他州立大学的文章共同作者Alex Boldyrev说:“极高的压力,比如在地球的核心或者其他巨型星体中,能够完全改变氦的化学特性。”
研究人员通过“晶体结构预测”模型进行演算发现,在极度的压力之下,一种稳定的氦钠化合物能够形成。然后他们在金刚石压腔实验中真的创造出了前所未见的化合物:Na2He。实验可以为氦和钠原子提供相当于110万倍地球大气压的条件。[1][2]
这一结果太出人意料,因此发表的时候遇到了巨大的困难,研究人员花了两年多的时间去说服审稿人和编辑。
基于这些结果,研究团队预测,如果压力达到他们实验水平的一千万倍,那么钠将可以很容易地和氦气反应生成稳定的Na2He。更为奇妙的是,这种化合物的构成并不需要任何化学键。
南开大学王慧田教授是本次研究的共同通讯作者,据他介绍:“所发现的化合物非常奇特:氦原子通常不会形成任何化学键,而新物质的存在从根本上改变了钠原子间的化学相互作用,迫使电子集中在该结构的立方空间内,同时具有绝缘能力。”[1][2]
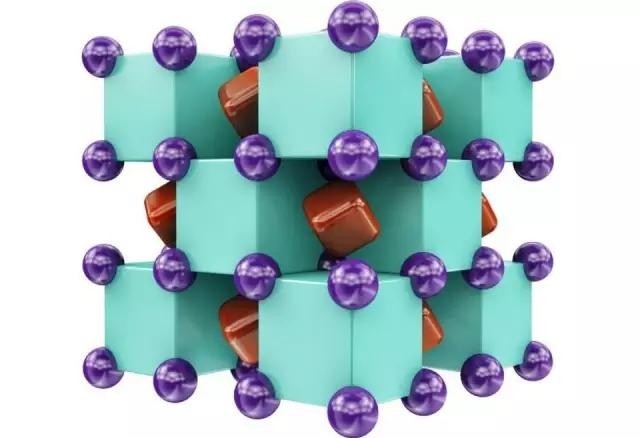 Na2He的晶体结构,由钠原子(紫色)和氦原子(绿色)交替,共用电子(红色)存在于其间的区域。[1][2]
Na2He的晶体结构,由钠原子(紫色)和氦原子(绿色)交替,共用电子(红色)存在于其间的区域。[1][2]
“这并不是真的化学键,”Popov说,“但是氦能够使这一结构稳定存在。如果你把氦原子挪走,该结构将无法保持稳定。”
下面是该化合物的其他表现形式,左图中粉色为钠,白色为氦;右图中钠和氦成立方体状,红色的点则是电子。[1][2]
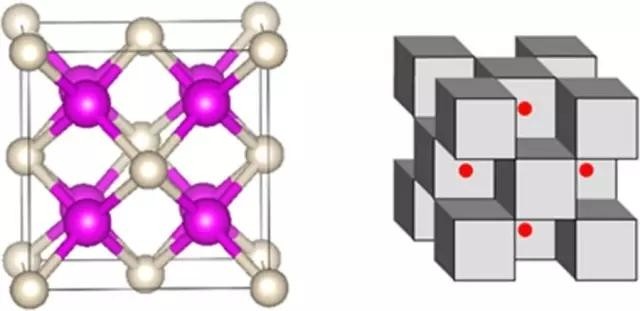
亚晶格分析表明,He的占位导致电子被局域到了原子缝隙中并在Na原子核的引力下形成多中心键,从而整个体系变成了电子盐体系。该过程中,孤立电子,Na的内层电子与He的内层1s电子和外层的2s,2p轨道产生强烈的交叠。受泡利不相容原理的影响,He的1s电子密度和外层电子轨道的分布被迫发生变化导致在Na2He形成过程中He得到了0.15个电子。该工作证实了高压下He会具有弱的化学活性能够与在高压下还原性显著增强的Na形成化合物。[1][2]
虽然最近关于金属氢的突破研究遇到很大的质疑,但这篇文章的数据要扎实很多。来自伦敦帝国学院的物理学家Henry Rzepa在把这项研究和金属氢的发现对比时表示:“这是更为可靠的科学,氦化合物是一项重大突破。”[2]
这一研究涉及中、美、俄、意、德五国学者。参与的中国研究单位还有北京高压科学研究中心、西北工业大学、中科院固态物理研究所和南京大学。特别值得一提的是,这一研究开始于南开大学研究生Xiao Dong在美国交换访问期间,根据作者贡献介绍,Xiao Dong设计了研究工作、并展开了相关计算。Xiao Dong目前已经在上海高压科学研究中心工作。[2]
据了解,这一工作2013年就投稿Nature,但作者与评审人就Na2He成健性质无法达成一致,最后改投Nature Chemistry发表。当然,并不是所有人都被说服。爱丁堡大学Eugene Gregoryanz就认为XRD数据有待提高,最终还要看这一工作是否能被其他团队所重复。不过,具备条件的实验室全世界没有几家。[2]
安全事项氦气瓶
已知的氦同位素有八种,包括氦3、氦4、氦5、氦6、氦8等,但只有氦3和氦4是稳定的,其余的均带有放射性。在自然界中,氦同位素中以氦4占最多,多是从其他放射性物质的α衰变,放出氦4原子核而来。而在地球上,氦3的含量极少,它们均是由超重氢(氚)的β衰变所产生。
氦-2:它的原子核只有2个质子,到目前为止只是假想粒子,但如果强核力增强2%,它就有可能存在。
氦-5,是氦的同位素之一,元素符号为He。它的原子核由二颗质子和三颗中子所组成。并带有放射性,会放出中子,其半衰期为0.6 MeV。
氦-6:原子核包含2个质子和4个中子,非常不稳定。
氦-7:原子核包含2个质子和5个中子,会衰变成氦-6,非常不稳定。
氦-8:原子核包含2个质子和6个中子,非常不稳定。
氦-9:原子核包含2个质子和7个中子,非常不稳定。
氦-10:原子核包含2个质子和8个中子,非常不稳定。
| 符号 | Z(p) | N(n) | 同位素质量(u) | 半衰期 | 原子核自旋 | 相对丰度 | 相对丰度的变化量 |
|---|---|---|---|---|---|---|---|
| 2He | 2 | 0 | 2.02946 # | 非常不稳定(假想粒子) # | 0+ #(推测) | 0 | 未知 |
| 3He | 2 | 1 | 3.0160293191(26) | 稳定 | 1/2+ | 0.00000134(3) | 4.6×10-10-0.000041 |
| 4He | 2 | 2 | 4.002,603,254,15(6) | 稳定 | 0+ | 0.99999866(3) | 0.999959-1 |
| 5He | 2 | 3 | 5.01222(5) | 700(30)E-24 s [0.60(2) MeV] | 3/2- | ||
| 6He | 2 | 4 | 6.0188891(8) | 806.7(15) ms | 0+ | ||
| 7He | 2 | 5 | 7.028021(18) | 2.9(5)E-21 s [159(28) keV] | (3/2)- | ||
| 8He | 2 | 6 | 8.033922(7) | 119.0(15) ms | 0+ | ||
| 9He | 2 | 7 | 9.04395(3) | 7(4)E-21 s [100(60) keV] | 1/2(-#) | ||
| 10He | 2 | 8 | 10.05240(8) | 2.7(18)E-21 s [0.17(11) MeV] | 0+ |
备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
氦气对人体的不良反应
| 符号 | Z(p) | N(n) | 同位素质量(u) | 半衰期 | 原子核自旋 | 相对丰度 | 相对丰度的变化量 |
|---|---|---|---|---|---|---|---|
| 2He | 2 | 0 | 2.02946 # | 非常不稳定(假想粒子) # | 0+ #(推测) | 0 | 未知 |
| 3He | 2 | 1 | 3.0160293191(26) | 稳定 | 1/2+ | 0.00000134(3) | 4.6×10-10-0.000041 |
| 4He | 2 | 2 | 4.002,603,254,15(6) | 稳定 | 0+ | 0.99999866(3) | 0.999959-1 |
| 5He | 2 | 3 | 5.01222(5) | 700(30)E-24 s [0.60(2) MeV] | 3/2- | ||
| 6He | 2 | 4 | 6.0188891(8) | 806.7(15) ms | 0+ | ||
| 7He | 2 | 5 | 7.028021(18) | 2.9(5)E-21 s [159(28) keV] | (3/2)- | ||
| 8He | 2 | 6 | 8.033922(7) | 119.0(15) ms | 0+ | ||
| 9He | 2 | 7 | 9.04395(3) | 7(4)E-21 s [100(60) keV] | 1/2(-#) | ||
| 10He | 2 | 8 | 10.05240(8) | 2.7(18)E-21 s [0.17(11) MeV] | 0+ |
词条图册
 氦(3)天然气分离法:工业上,主要以含有氦的天然气为原料,反复进行液化分馏,然后利用活性炭进行吸附提纯,得到纯氦。合成氨法:在合成氨中,从尾气经分离提纯可得氦。
氦(3)天然气分离法:工业上,主要以含有氦的天然气为原料,反复进行液化分馏,然后利用活性炭进行吸附提纯,得到纯氦。合成氨法:在合成氨中,从尾气经分离提纯可得氦。
空气分馏法:从液态空气中用分馏法从氖氦混合气中提出。
铀矿石法:将含氦的铀矿石经过焙烧,分离出气体,再经过化学方法,除去水蒸气、氢气和二氧化碳等杂质提纯出氦。



 求购
求购





