- 后肾腺瘤

后肾腺瘤
概述
有人认为MA 起源于
生肾原始细胞。也有研究认为乳头状肾细胞癌和MA 之间有密切联系可发生于任何年龄, 以50~ 60 岁多见, 男女之比约1 : 2, 一般单侧受累。1992 年Brisicotti 首先命名了后肾腺瘤(Metanephricadenoma,MA) ,是一种十分罕见的肾原发肿瘤,其边界清楚,具有独特的病理组织学结构,约占成人肾上皮肿瘤0. 2%,属于最新WHO( 2004)肾脏肿瘤分类中“后肾肿瘤”大类。
临床症状
大多数患者无明显症状及体征, 50%的病例为偶然发现, 约10% 的患者可伴有红细胞增多症, 可表现为腰腹部疼痛、血尿、肿块及间歇性发热等, 可伴有遗传性假性血友病相关症状。MA 肿块大小不一, 直径多为30~ 60 mm。
病理学特征
大体病理
MA 大小的差异十分显著,最常见的直径为30 ~ 60mm,少见多灶性。典型者肿瘤边界清楚,无包膜,切面可呈灰色,褐色及黄色,质地软或硬。常见灶状出血和坏死,约20% 肿瘤内有钙化[1], 10%肿瘤内有小囊腔。Obulareddy 等报道是有包膜,且包膜完整。
镜下结构
镜下主要有以下结构:小腺泡状结构:这是肿瘤组织学特征之一。肿瘤细胞密集或散在分布,部分排列成小腺泡状结构,肿瘤体积较小,胞浆少,核圆形或椭圆形,略大于淋巴细胞,大小一致。核仁不明显,无明显异型性,无核分裂像或者罕见核分裂像。管状结构: 部分细胞排列成长条状,分支管状结构。乳头状结构: 也为
常见结构之一。肾小球及花蕾状结构: 在稍大一些的腔隙内细胞堆积成球团状,类似新生儿肾小球结构。如分化差时细胞密集排列呈同心圆状细胞团,似花蕾样。此两种特殊形状是本瘤所具有的独特结构,具有诊断和鉴别诊断价值。微囊结构: 部分病例中可见局灶性大小不等的,形状不规则的腔隙样结构,其所占比例各不相同。少数病例以此种结构为主,类似多囊肾,但其囊与囊之间或周围组织中总能见有上述小圆形细胞及小腺泡
状结构。间质: 淡染,无或极少细胞,分布在小腺泡之间,不含后肾胚芽,组织结构类似肾母细胞瘤的错构瘤成分。部分肿瘤出现坏死、少量沙粒体。
电镜检查
瘤细胞大小相对一致,不成熟,核无极性,细胞浆内细胞器(线粒体、核糖体、粗面内质网) 稀少,排列成小管状或花环状的上皮细胞构成。上皮细胞腔面有微绒毛,肿瘤性小管周围有较为丰富的基底膜围绕,细胞间存在细胞连接。并可见细胞顶端的微绒毛及分泌颗粒。
免疫表型
有关MA 免疫表型特点的研究各文献报道不一。近年研究发现多数病例WT1、CD57、Vimentin 弥漫阳性表达,CK7灶性阳性或阴性表达,而CD56,CS - 100,NSE,CEA,CgA,Syn,AFP,Actin,Desmin,HMB45,AMACR 表达阴性。部分病例偶见α - 胰蛋白酶、MSA 阳性,EMA 多阴性。其中WT 基因WT1 编码一种作为转录激活子
和肿瘤抑制因子的蛋白,是调节正常胚胎肾脏、卵巢和睾丸发育的重要因子。WT1 主要见于包括发育中的肾单位、间皮等胚胎组织。在肾肿瘤主要见于Wilms 瘤,WT1 在MA 的表达提示MA 和Wilms 瘤在组织发生上可能有一定的关联。WT1在MA 的亦有阴性表达,本例WT1 亦呈阴性。CD57 为一种糖蛋白,见于发育中肾单位近肾小球
的近曲小管及成人近曲小管,肾肿瘤中已见MA、部分肾透明细胞癌、肾类癌的表达的报道。又报道α - 甲基- CoA消旋酶( AMACR) 染色可以作为MA 鉴别诊断重要指标,MA 多呈阴性表达,在大多数乳头状肾细胞癌( PRCC) 均有强的表达。有学者比较了PRCC、Wilms 瘤和MA免疫组化特点: AMACR 多在PRCC 表达阳性,而Wilms 瘤和MA 阴性。与之相反WT1 在Wilms 瘤和MA 多表达阳性,而PRCC 阴性。故AMACR、WT1 可用于PRCC 与Wilms 瘤、MA 的鉴别。
分子遗传学
关于MA 有无染色体的异常,文献一直存在争论。Brown 等人对11 例MA进行了FISH 研究,结果证实MA 存在7, 17 号染色体异常及性染色体( X 或Y) 的丢失,因此认为MA与肾乳头状细胞癌有相关性,但大多数文献及WHO 肿瘤分类中( 2004 ) 表明MA 无染色体异常[6,8]。研究同时表明,MA 并不存在Wilms 瘤所特有的遗传学染色体11P13等位基因失衡,说明MA 与Wilms 瘤在遗传学上是完全不同的肿瘤实体。
影像学资料
超声检查
多为界清、类圆形、低或高回声的实性肿块, 可有液性暗区及周围低回声环;囊肿样表现者罕见。
CT检查
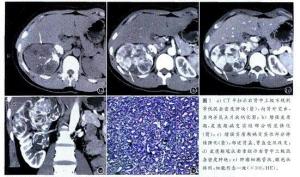 后肾腺瘤CT表现CT平扫肿瘤边缘清晰, 相对周围肾脏实质多为低密度、等密度或均匀性高密度, 可有斑片状出血、坏死囊变区及点状钙化, 增强后实质部分多无或轻度强化, 还可有延迟增强表现。
后肾腺瘤CT表现CT平扫肿瘤边缘清晰, 相对周围肾脏实质多为低密度、等密度或均匀性高密度, 可有斑片状出血、坏死囊变区及点状钙化, 增强后实质部分多无或轻度强化, 还可有延迟增强表现。
MR检查
MRT1WI 多呈低信号, T2WI 低或稍高信号。大多数MA 经单纯肿块切除术后即可治愈。文献中有转移到骨和淋巴结的报道, 因此手术切除后应行长期影像学监测和随访。临床若遇到肾脏肿块并伴有红细胞增多症及相对典型的CT 表现, 应想到M A 可能。
治疗与预后
MA 是一种相对良性的肿瘤。预后较好。但在临床工作中,因为该肿瘤难以与恶性肿瘤鉴别,故多行根治性肾脏切除,而在术后病理得到确诊。大多数观点认为该肿瘤经随访无复发及转移,预后良好。但也有数篇文献报道存在局部转移的病例[9 - 11],WHO( 2004) 对其生物学特性亦无明确表示,仅提到存在不止1 例病例有局部转移,但无进一步发展,其中1 例MA 中出现肉瘤成分,提示其生物学行为的不确定性。因此,MA 并不能完全认为是良性病变,应长期密切随访。

-
自主性高功能性甲状腺腺瘤
2025-10-04 05:37:36 查看详情 -
促肾上腺皮质激素细胞腺瘤
2025-10-04 05:37:36 查看详情 -
腺瘤性甲状旁腺亢进综合症
2025-10-04 05:37:36 查看详情


 求购
求购






