- 扩展蛋白

扩展蛋白
蛋白介绍
普遍存在于正在生长的植物组织和成熟的果实之中。
应用学科:生物化学与分子生物学(一级学科)
氨基酸、多肽与蛋白质(二级学科)细胞结构与细胞外基质(二级学科)。
基本概述
Expansin是一种参与了植物细胞壁舒张的蛋白质,它的发现始自1989年美国宾夕法尼亚州立大学Cosgrove等人对黄瓜下胚轴细胞延伸性的研究。在他们当时的实验中发现,黄瓜根尖细胞壁的某些蛋白提取物可有效恢复已变性细胞壁的伸展。在之后的研究中他们将这类新发现的蛋白命名为expansin,即能松弛细胞壁的一类蛋白。 自那以后的二十多年来, 关于伸展蛋白结构的研究, 已经获得了突破性的结果。 对其功能的认识也已比较深刻和全面。 关于它的交联( crosslinking ) 和生物合成,虽然研究时间不长, 但也取得了较大的进展。近几年我国对扩展蛋白及细胞壁其它成分研究中的某些方面也已开始有所涉及和深入。
结构
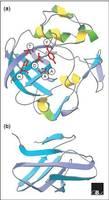 扩展蛋白结构图其氨基末端为约 2 2个氨基酸编码的信号肽,进入分泌途径后被剪切, 使扩张蛋白成为成熟肽 。该蛋白碳末端假定的结合 区域 ( 约10kDa ) 含有一系列保守的色氨酸残基 ( w) , 这些色氨酸残基有一定的间隔,很像纤维酶 的纤维素结合区域。中间区域 ( 1 5 k Da ) 被认为是重要的催化区域,氨基酸序列相似于 f a mi l y 一 4 5糖基水解酶的催化区域 。在这个催化 区域中半胱氨酸很可能在二硫键的形成中起作用。保守的天冬氨酸残基 ( D) 组成了 family一45 水解酶催化位点的关键残基,这些残基在 α-expansin和 β-expansin 也有相一致的位置。两者基因中均含两个保 守的内含子位置。
扩展蛋白结构图其氨基末端为约 2 2个氨基酸编码的信号肽,进入分泌途径后被剪切, 使扩张蛋白成为成熟肽 。该蛋白碳末端假定的结合 区域 ( 约10kDa ) 含有一系列保守的色氨酸残基 ( w) , 这些色氨酸残基有一定的间隔,很像纤维酶 的纤维素结合区域。中间区域 ( 1 5 k Da ) 被认为是重要的催化区域,氨基酸序列相似于 f a mi l y 一 4 5糖基水解酶的催化区域 。在这个催化 区域中半胱氨酸很可能在二硫键的形成中起作用。保守的天冬氨酸残基 ( D) 组成了 family一45 水解酶催化位点的关键残基,这些残基在 α-expansin和 β-expansin 也有相一致的位置。两者基因中均含两个保 守的内含子位置。
Expansin的分子量保持在25-27kD左右,初生的Expansin结构中包含一段长度为20-30个氨基酸的信号肽,其作用是引导多肽到达至细胞壁结构。成熟的Expansin约含有250-275个氨基酸并包含两个主要的结构域。其中,结构域一是位于整个蛋白序列中段的催化域(catlysis domain,catdom),含120-135个氨基酸单位,这段区域内半胱氨酸含量较为丰富,一般分布有6个保守的半胱氨酸和一个组氨酸域,据推测可能与二硫键形成有密切关系;结构域二存在于Expansin的羧基端,一般包含有90-120个氨基酸单位,具有4个保守的色氨酸残基丰富域,可与细胞壁中的纤维素相结合,该域对PH变化敏感,可导致分子构象发生变化。
作用特点
目前研究的细胞壁蛋白中,expansin是唯一能在体外诱导变性细胞壁扩展,细胞体膨大的蛋白。此外,随着此类基因的克隆和相关功能研究分析的不断深入发现,expansin超级家族中的成员参与了植物体整个生长发育过程中的大部分事件,从种子的萌发,根毛的生长到茎叶的发育,从花粉管的延长,叶柄脱落到果实的软化成熟等,都可以看到expansin超级家族成员的身影。另外,近些年来在植物体抗逆性研究的过程中,一些成果也发现或证明了存在expansin基因参与的结论。
扩展蛋白( Expansin ) 的结构特性决定了该蛋白与之前发现的众多细胞壁蛋白有所不同,它具有诱导热钝化的离体细胞壁恢复伸展的功 能,同一植物 的扩张蛋 白 不仅可以诱导自身离体细胞壁的伸展,而且可以诱导其它植物离体细胞壁的伸展。例如, 黄瓜 下胚轴扩张蛋白除了能诱导 自身离体细胞壁的伸展外,还可以诱导其它植物 , 如双子叶植物豌豆、 胡萝卜、 西红柿下胚轴和单子叶植物玉米胚芽鞘, 以及百合花、 洋 葱幼叶离体细胞壁的伸展。此外还具有如下作用特 点: 具有热敏感性; 具有 pH依赖性, 在 4.0 ~ 5.0之间 活性最强: 有最适温度 , 约 2 5 ~ 3 0 ℃; 可逆变性; 浓度效应 ,超过一定的浓度 ,伸展活性几乎不再增加 ;化学变性,细胞壁的重组伸展活性不依赖 于外源扩张蛋白的继续存在 。一些化学试剂如离子型和非离子型去垢剂能够钝化细胞壁钝重组伸展活性;不具外切聚糖酶活性。
本页面的文字允许在CC-BY-SA 3.0协议和GNU自由文档许可证下修改和再使用。



 求购
求购









