- 米氏常数

米氏常数
基本简介
非竞争性抑制剂米氏常数不变,最大反应速度减小;竞争性抑制剂米氏常数增大而,最大反应速度不变。
Km:米氏常数,是研究酶促反应动力学最重要的常数。
历史沿革
在20世纪初期,就已经发现了酶被其底物所饱和的现象,而这种现象在非酶促反应中,则是不存在的,后来发现底物浓度的改变,对酶反应速度的影响较为复杂,1913年前后Michaelis和Menten作了大量的定量研究,积累了足够的实验证据,从酶被底物饱和的现象出发,按照中间产物设想,提出了酶促反应动力学的基本原理,并归纳为一个数学表达式,称之为米氏方程式:
[E]+[S]↔[ES]↔P+[E]
v=Vm[s]/(Km+[s])=Vm/(1+Km/[s])
式中,[E]为游离酶浓度;[S]为底物浓度;[ES]为酶与底物结合的中间络合物浓度;v为酶促反应速度;Vm为酶促反应最大速度;Km为米氏常数,是酶促反应达最大速度(Vm)一半时的底物(S)的浓度
定理定义
米氏常数-定义 k1 k3
E+S〈——〉ES〈——〉E+P
k2 k4
其中,E为酶,S为底物,P为产物,k1,k2,k3,k4为反应速率
Km=(k2+k3)/k1
基本意义
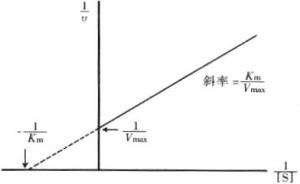 米氏常数 它的意义如下: 它的数值等于 酶促反应达到其最大速度Vm一半时的底物浓度〔S〕,图示以及公式推导。 它可以表示酶和底物之间的亲和能力,Km值越大,亲和能力越弱,反之亦然。 它可以确定一条 代谢途径中的限速步骤:代谢途径是指由一系列彼此密切相关的生化反应组成的代谢过程,前面一步反应的产物正好是后面一步反应的底物,例如, EMP途径。限速步骤就是一条代谢途径中反应最慢的那一步,Km值最大的那一步反应就是,该酶也叫这条途径的 关键酶。 它可以用来判断酶的最适底物,某些酶可以催化几种不同的生化反应,叫多功能酶,其中Km值最小的那个反应的底物就是酶的最适底物。 Km是一种酶的特征常数,只与酶的种类有关而与酶的浓度无关,与底物的浓度也无关,这一点与Vm是不同的,因此,我们可以通过Km值来鉴别酶的种类。但是它会随着反应条件(T、PH)的改变而改变。非竞争性抑制剂米氏常数不变,最大反应速度减小;反竞争性抑制剂米氏常数减小,最大反应速度减小。
米氏常数 它的意义如下: 它的数值等于 酶促反应达到其最大速度Vm一半时的底物浓度〔S〕,图示以及公式推导。 它可以表示酶和底物之间的亲和能力,Km值越大,亲和能力越弱,反之亦然。 它可以确定一条 代谢途径中的限速步骤:代谢途径是指由一系列彼此密切相关的生化反应组成的代谢过程,前面一步反应的产物正好是后面一步反应的底物,例如, EMP途径。限速步骤就是一条代谢途径中反应最慢的那一步,Km值最大的那一步反应就是,该酶也叫这条途径的 关键酶。 它可以用来判断酶的最适底物,某些酶可以催化几种不同的生化反应,叫多功能酶,其中Km值最小的那个反应的底物就是酶的最适底物。 Km是一种酶的特征常数,只与酶的种类有关而与酶的浓度无关,与底物的浓度也无关,这一点与Vm是不同的,因此,我们可以通过Km值来鉴别酶的种类。但是它会随着反应条件(T、PH)的改变而改变。非竞争性抑制剂米氏常数不变,最大反应速度减小;反竞争性抑制剂米氏常数减小,最大反应速度减小。

-
杜兴氏肌肉营养不良症
2025-10-31 10:19:37 查看详情


 求购
求购






