- 肝癌

肝癌
流行病学
 肝癌(8)近年来原发性肝癌的发病率在全球范围内均有增加趋势,居恶性肿瘤的第5位,死亡率位居恶性肿瘤的第3位。我国是肝癌的高发国家,肝癌病例约占全球的55%,死亡率仅次于肺癌,位居第二。
肝癌(8)近年来原发性肝癌的发病率在全球范围内均有增加趋势,居恶性肿瘤的第5位,死亡率位居恶性肿瘤的第3位。我国是肝癌的高发国家,肝癌病例约占全球的55%,死亡率仅次于肺癌,位居第二。
肝癌的发病率在不同地域间具有明显差异。东亚的发病率最高,其次为非洲撒哈拉地区、东南亚和南欧,而北欧及美洲的发病率最低。国内沿海高于内地,东南和东北高于西北、华北和西南,其中江苏启东、福建同安、广东顺德、广西扶绥是高发区。男:女比例为2.7:1。[1]
发病病因
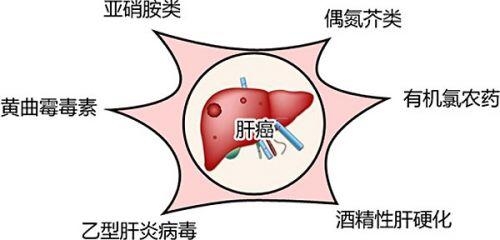
原发性肝癌的病因尚不完全清楚,可能是多因素协同作用的结果。根据流行病学的调查,多认为与以下易患因素有关。
 肝癌
肝癌
(一)病毒性肝炎
病毒性肝炎是原发性肝癌诸多致病因素中的最主要因素,其中以慢性乙型和丙型肝炎最为常见。由于不同国家和地域病毒性肝炎的流行病学不同,故原发性肝癌患者肝炎病毒的检出率不同。我国肝癌患者中HBV的检出率高90%,而在欧美及日本等HCV感染的高发国家及地区,肝癌患者的HCV检出率高。
HBV的致癌机制复杂,目前多认为是由于HBVDNA与宿主DNA的整合、HBV游离复制型缺陷病毒的存在以及HBV的某些基因产物使宿主基因组丧失稳定性,激活或抑制包括癌基因和抑癌基因在内的细胞生长调控基因的表达,进而促进肝细胞癌变。HCV的致癌机制不同于HBV,其可能是通过表达基因产物间接影响细胞的增殖分化而诱发肝细胞恶变。基因1型HCV感染者较其他基因型感染者更易发生肝癌:HBV/HCV重叠感染或合并HIV感染者发生肝癌的风险性明显增加:血清肝炎病毒检测值长期处于高水平者更易发展为肝癌。
(二)肝硬化
存在不同原因所致肝硬化是大多数肝细胞癌的共同特征,约70%的原发性肝癌发生在肝硬化的基础上,且多数是慢性乙型和慢性丙型肝炎发展而成的结节型肝硬化。有调查表明平均每年约有3%~6%的乙型肝炎肝硬化和1%-7%的丙型肝炎肝硬化患者发展为肝癌。抗病毒治疗有助于阻止慢性乙型和丙型肝炎进展为肝硬化,不过一旦形成肝硬化,即使采用规范的抗病毒治疗,其仍有进展为肝癌的风险。酒精性肝硬化合并HBV、HCV感染者发生肝癌的风险性更大。
(三)黄曲霉毒素污染
 肝癌黄曲霉毒素至少有13种亚型,其中黄曲霉毒素B1(AFB1)的毒性最强。流行病学资料表明食物中AFB1的含量与肝癌的发生率呈正相关。非洲、亚洲中部及东南部既是HBV的高流行区,又是粮油及食品受AFB1污染较重的地区,两个危险因素在原发性肝癌的发生与发展中发挥协同作用,故上述地域的肝癌发生率较高。
肝癌黄曲霉毒素至少有13种亚型,其中黄曲霉毒素B1(AFB1)的毒性最强。流行病学资料表明食物中AFB1的含量与肝癌的发生率呈正相关。非洲、亚洲中部及东南部既是HBV的高流行区,又是粮油及食品受AFB1污染较重的地区,两个危险因素在原发性肝癌的发生与发展中发挥协同作用,故上述地域的肝癌发生率较高。
AFB1是一种前致癌物质,其在肝脏先经微粒体中CYP450酶系代谢,然后再经谷胱甘肽转移酶和其他Ⅱ相酶类降解而完成生物转化过程。谷胱甘肽转移酶Ml(GSTM1)基因在遗传上的多态性导致不同个体对摄入AFB1生物转化能力的差异。生活在AFB1高污染地区并存在GSTM1纯合子缺失者发生肝癌的危险性增加。
(四)家族史及遗传因素
在原发性肝癌的高发地区,家族史是原发性肝癌发生的重要危险因素,其生物学基础尚不清楚。流行病学的调查表明某些具有诱发肝癌风险的隐性等位基因的存在可能与机体能否清除或抑制HBV感染相关;CYP450、GSTM1、NAT2 以及p53基因遗传多态性也与肝癌的家族聚集现象有一定的关联。此外,携带低活性Thl细胞因子基因和高活性Th2细胞因子基因的个体肝癌发生的风险性明显增加。
(五)其他因素
某些化学物质和药物如亚硝胺类、偶氮芥类、有机氯农药、雄激素以及某些类固醇均是致肝癌危险因素。HBV或HCV感染者若长期服用避孕药可增加肝癌发生的风险性。长期酗酒者肝癌的风险性增加,戒酒可明显降低其风险性。铁代谢障碍、低硒、钼、锌、锰以及高镍、砷也被认为与肝癌发生相关。近来还有研究表明肝癌患者螺杆菌属感染率高。
上述多种多种环境、遗传因素共同作用诱导癌基因的激活和抑癌基因的失活,最终导致肝细胞生长失控,发生癌变。自前已发现人类肝癌组织中存在多种激活并过表达的癌基因,如c-fos、c-myc、c-erbB2、c-met等。抑癌基因通常处于隐性状态,当发生了杂合性缺失(loss of heterozygosity,LOH),即染色体某一基因座上的等位基因之一出现缺失或突变,就可诱导细胞发生癌变。已发现人类肝癌在多个染色体区都可发生LOH,如17pl3.1(P53)、6q26-27(M6P/IGF2R)、8p21.3-22(DLC1)和13ql2-q32(Rb和BRCA2)。
除癌基因的活化和抑癌基因的失活外,多种生长因子,如胰岛素和胰岛素样生长因子1和2(IGF.1和IGF-2)、胰岛素受体底物1(IRS-1)、转化生长因子α和β1(TGFa 和TGFβ1)介导的信号途径以及染色体末端特异的DNA结构-端粒的进行性缩短及端粒酶的激活也被认为与肝癌的发生密切相关。[1]
临床表现
 肝癌原发性肝癌起病隐匿,早期症状常不明显,故也称亚临床期。出现典型的临床症状和体征时一般已属中、晚期。
肝癌原发性肝癌起病隐匿,早期症状常不明显,故也称亚临床期。出现典型的临床症状和体征时一般已属中、晚期。
(一)症状
1.肝区疼痛:多为肝癌的首发症状、表现为持续钝痛或胀痛。疼痛是由于癌肿迅速生长使肝包膜被牵拉所致。如肿瘤生长缓慢或位于肝实质深部也可完全无疼痛表现。疼痛部位常与肿瘤位置有关,若肿瘤位于肝右叶疼痛多在右季肋部,肿瘤位于左叶时常表现为上腹痛,有时易误诊为胃部疾患;当肿瘤位于肝右叶膈顶部时,疼痛可牵涉右肩。癌结节破裂出血可致剧烈腹痛和腹膜刺激征,出血量大时可导致体克。
2.消化道症状:食欲减退、腹胀、恶心、呕吐、腹泻等消化道症状,可由肿瘤压迫、腹水、胃肠道淤血及肝功能损害而引起。
3.恶性肿瘤的全身表现:进行性乏力、消瘦、发热、营养不良和恶病质等。
4.伴癌综合征(paraneoplastic syndrome):指机体在肝癌组织自身所产生的异位激素或某些活性物质影响下而出现的一组特殊综合征,可与临床表现同时存在,也可先于肝癌症状。以自发性低血糖、红细胞增多症为常见,有时还可伴有高钙血症、高脂血症、类癌综合征、血小板增多、高纤维蛋白原血症等。
(二)体征
1.肝大:为中晚期肝癌的主要体征,最为常见。多在肋缘下触及,呈局限性隆起,质地坚硬。左叶肝癌则表现为剑突下包块。如肿瘤位于肝实质内,肝表面可光滑,伴或不伴明显压痛。肝右叶膈面肿瘤可使右侧膈肌明显抬高。
2.脾肿大:常为合并肝硬化所致。肿瘤压迫或门静脉、脾静脉内癌栓也能引起淤血性脾肿大。
3.腹水:腹水为草黄色或血性,多数是在肝硬化的基础上合并门静脉或肝静脉癌栓所致。肝癌浸润腹膜也是腹水的常见原因。
4.黄疸:多为晚期征象,以弥漫型肝癌或胆管细胞癌为常见。癌肿广泛浸润可引起肝细胞性黄疸。当侵犯肝内胆管或肝门淋巴结肿大压迫胆管时,可出现梗阻性胆汁淤积。
5.其他:由于肿瘤本身血管丰富,再加上癌肿压迫大血管,故可在肝区出现血管杂音。肝区摩擦音提示肿瘤侵及肝包膜。肝外转移时则有转移部位相应的体征。
(三)肝癌的转移途径及转移灶的临床表现
1.肝内转移:肝组织有丰富的血窦,癌细胞有向血窦生长的趋势而且极易侵犯门静脉分支,形成门静脉癌栓,导致肝内播散。一般先在同侧肝叶内播散,之后累及对侧肝叶。进步发展时癌栓可波及门静脉的主要分支或主干;可引起门静脉高压,并可导致顽固性腹水。
2.肝外转移:肝癌细胞通过肝静脉进入体循环转移至全身各部,最常见转移部位为肺,可引起咳嗽、咯血。此外还可累及肾上腺、骨、脑等器官。骨和脊柱转移时出现局部疼痛和神经受压症状,颅内转移可出现相应的定位症状。淋巴道转移中以肝门淋巴结最常见,此外也可转移至主动脉旁、锁骨上、胰、脾等处淋巴结。肝癌也可直接蔓延,浸润至邻近腹膜及器官组织如膈肌、结肠肝曲和横结肠、胆囊及胃小弯。种植转移发生率较低,若种植于腹膜可形成血性腹水,女性患者尚可种植在卵巢,形成较大肿块。[1]
临床分期
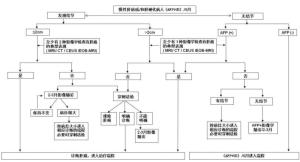
 肝癌肝癌的分期对于预后的评估、合理治疗方案的选择至关重要。影响肝癌病人预后的因素很多,包括肿瘤因素、病人一般情况及肝功能情况,据此国外有多种的分期方案,如:BCLC、TNM、JSH、APASL等分期。依据中国的具体国情及实践积累,推荐下述肝癌的分期方案,包括:1a期、b期、la期、Ib期、lla期、llb期、IV期,具体分期方案如图1所示。[2]
肝癌肝癌的分期对于预后的评估、合理治疗方案的选择至关重要。影响肝癌病人预后的因素很多,包括肿瘤因素、病人一般情况及肝功能情况,据此国外有多种的分期方案,如:BCLC、TNM、JSH、APASL等分期。依据中国的具体国情及实践积累,推荐下述肝癌的分期方案,包括:1a期、b期、la期、Ib期、lla期、llb期、IV期,具体分期方案如图1所示。[2]
并发病症
 肝癌1.肝性脑病:是肝癌终末期并发症,占死亡原因的1/3。
肝癌1.肝性脑病:是肝癌终末期并发症,占死亡原因的1/3。
2.消化道出血:约占肝癌死亡原因的15%。合并肝硬化或门静脉、肝静脉癌栓者可导致食管胃底静脉曲张破裂出血。胃肠道黏膜糜烂、凝血功能障碍也可是消化道出血的原因。
3.肝癌结节破裂出血:发生率约9%~14%。肝癌组织坏死液化可自发破裂,也可在外力作用下破裂。若出血限于包膜下可有急骤疼痛,肝脏迅速增大;若破入腹腔可引起急性腹痛和腹膜刺激征,严重者可致出血性休克或死亡。小量出血则表现为血性腹水。
4.继发感染:因癌肿长期消耗,尤其在放疗、化疗后白细胞减少的情况下,抵抗力减弱,再加上长期卧床等因素,易并发各种感染,如肺炎、肠道感染、真菌感染等。[1]
辅助检查
 肝癌(一)肝癌的影像学检查: 各种影像学检查手段各有特点,应该强调综合应用、优势互补、全面评估。
肝癌(一)肝癌的影像学检查: 各种影像学检查手段各有特点,应该强调综合应用、优势互补、全面评估。
1. 超声检查(Ultrasonography, US):
腹部超声检查因操作简便、灵活直观、无创便携等特点,是临床上最常用的肝脏影像学检查方法。常规超声筛查可以早期、敏感地检出肝内可疑占 位性病变,准确鉴别是囊性或实质性占位,并观察肝内或腹部有无其他相关转移灶。彩色多普勒血流成像不仅可以观察病灶内血供,也可明确病灶与肝内重要血管的毗邻关系,为临床治疗方法的选择及手术方案的制定提供重要信息。实时超声造影技术可以揭示肝肿瘤的血流动力学改变,帮助鉴别和诊 断不同性质的肝肿瘤,凭借实时显像和多切面显像的灵活特性,在评价肝肿瘤的微血管灌注和引导介入治疗方面具有优势。
2. X 线计算机断层成像(Computed Tomography, CT):
常规采用平扫+增强扫描方式(常用碘对比剂),其检出和诊断小肝癌能力总体略逊于磁共振成像。目前除常见应用于肝癌临床诊断及分 期外,更多应用于肝癌局部治疗的疗效评价,特别对经肝动脉化疗栓塞(Transarterial chemoembolization ,TACE)后碘油沉积观察有优势。同 时,借助 CT 的三维肝体积和肿瘤体积测量、肺和骨等其它脏器转移评价,临床应用广泛。
3. 磁共振成像(Magnetic Resonance Imaging, MRI):
常规采用平扫+增强扫描方式(常用对比剂 Gd-DTPA),因其具有无辐射影响,组织分辨率高,可以多方位、多序列参数成像,并具有形 态结合功能(包括弥散加权成像、灌注加权成像和波谱分析)综合成像技术能力,成为临床肝癌检出、诊断和疗效评价的常用影像技术。若结合肝细胞特异性对比剂(Gd-EOB-DTPA)使用,可提高≤1.0cm 肝癌的检出率和对肝癌诊断及鉴别诊断的准确性 4-9。 在 MRI 或 CT 增强扫描动脉期(主要在动脉晚期),肝癌呈不均匀明显强化,偶可呈均匀明显强化,尤其是≤5.0cm 的肝癌,门脉期和/ 或实质平衡期扫描肿瘤强化明显减弱或降低,这种“快进快出”的增强方式是肝癌诊断的特点。 肝癌 MRI 和 CT 诊断,尚需结合其它征象(如假包膜等),尤其是 MRI 其它序列上相关征象进行综合判断,方能提高肝癌诊断准确性。
4.数字减影血管造影(Digital Subtraction Angiography, DSA):
DSA 是一种侵入性创伤性检查,多主张采用经选择性或超选择性肝动脉进行 DSA 检查,该技术更多用于肝癌局部治疗或急性肝癌破裂出 血治疗等。肝癌在 DSA 的主要表现是肿瘤血管和肿瘤染色,还可以明确显示肝肿瘤数目、大小及其血供情况。DSA 能够为血管解剖变异和重 要血管解剖关系以及门静脉浸润提供正确客观的信息,对于判断手术切除的可能性和彻底性以及决定合理的治疗方案有重要价值。
5.核医学影像检查:
1)正电子发射计算机断层成像(Positron Emission Tomography/CT, PET/CT) :氟-18-脱氧葡萄糖(18F-FDG)PET/CT 全身显像的优势在 于:①对肿瘤进行分期,通过一次检查能够全面评价淋巴结转移及远处器官的转移;②再分期,因 PET 功能影像不受解剖结 构的影响,可准确显示解剖结构发生变化后或者是解剖结构复杂部位的复发转移灶;③疗效评价,对于抑制肿瘤活性的靶向 药物,疗效评价更加敏感、准确 ;④指导放疗生物靶区的勾画、穿刺活检部位;⑤评价肿瘤的恶性程度和预后。碳-11 标记的乙酸盐(11C-acetate)或胆碱(11C-choline)PET 显像可提高对高分化肝癌诊断的灵敏度,与 18F-FDG PET/CT显像具有互补作用。
2)发射单光子计算机断层扫描仪(SPECT-CT): SPECT/CT 已逐渐替代 SPECT 成为核医学单光子显像的主流设备,选择全身平面显像所 发现的病灶,再进行局部 SPECT/CT 融合影像检查,可同时获得病灶部位的 SPECT 和诊断 CT 图像,诊断准确性得以显著提高。
6. 肝穿刺活检:
具有典型肝癌影像学特征的占位性病变,符合肝癌的临床诊断标准的病人,通常不需要以诊断为目的肝穿刺活检。对于缺乏典型肝癌影像学特征 的占位性病变,肝穿刺活检可获得病理诊断,对于确立肝癌的诊断、指导治疗、判断预后非常重要。
肝穿刺活检需要在超声或 CT 引导下进行,可采用 18G 或 16G 肝穿刺空芯针活检获得组织学诊断,也可用细针穿刺获得细胞学诊断。肝穿刺活检主 要的风险是出血或针道种植。因此,术前应检查血小板和凝血功能,对于有严重出血倾向或严重心肺、脑、肾疾患和全身衰竭的病人,应避免肝穿刺活 检。为了避免肿瘤结节破裂和针道种植,在选择穿刺路径需要经过正常的肝组织,避免直接穿刺肝脏表面的结节。推荐在肿瘤和肿瘤旁肝组织分别穿刺 1 条组织,以便客观对照提高诊断准确性。肝穿刺的病理诊断存在一定的假阴性率,阴性结果不能完全排除肝癌的可能。
(二)肝癌的血清学分子标记物:
血清甲胎蛋白(Alpha-fetoprotein, AFP)是当前诊断肝癌常用而又重要的方法。诊断标准:AFP≥400μg/L,排除慢性或活动性肝炎、肝硬化、睾丸 或卵巢胚胎源性肿瘤以及怀孕等。AFP 低度升高者,应作动态观察,并与肝功能变化对比分析,有助于诊断。约 30%的肝癌病人 AFP 水平正常,检测甲胎蛋白异质体,有助于提高诊断率。其它常用的肝癌诊断分子标志物:包括α-L-岩藻苷酶、异常凝血酶原等。
(三)肝癌的病理学诊断:
1. 肝癌病理学诊断标准: 肝脏占位病灶或者肝外转移灶活检或手术切除组织标本,经病理组织学和/或细胞学检查诊断为肝癌。病理诊断须与临床证据相结合,全面了解病人 的 HBV/HCV感染史、肿瘤标志物以及影像学检查等信息。
 肝癌2. 肝癌病理诊断规范: 肝癌病理诊断规范由标本处理、标本取材、病理检查和病理报告等部分组成。
肝癌2. 肝癌病理诊断规范: 肝癌病理诊断规范由标本处理、标本取材、病理检查和病理报告等部分组成。
1)标本处理要点:①手术医生应在病理申请单上标注送检标本的部位、种类和数量,对手术切缘和重要病变可用染料染色或缝线加以标记;②尽可能 将肿瘤标本在离体 30 min 以内完整送达病理科切开固定;③10%中性福尔马林溶液固定 12~24 小时。
2)标本取材要点:肝癌周边区域是肿瘤生物学行为的代表性区域。为此,应采用“7 点”基线取材法(图 2),在肿瘤的 12 点、3 点、6 点和 9 点位 置上于癌与癌旁肝组织交界处取材按 1:1 取材;在肿瘤内部至少取材 1 块;对距肿瘤边缘≤1cm(近癌旁)和>1cm(远癌旁)范围内的肝组织分别取材 1 块。鉴于多结节性肝癌具有单中心和多中心两种起源方式,在不能除外由肝内转移引起的卫星结节的情况下,单个肿瘤最大直径≤3cm 的肝癌,应全部取材检查。实际取材的部位和数量还须根据肿瘤的直径和数量等情况考虑。[2]
医学诊断
结合肝癌发生的高危因素、影像学特征以及血清学分子标记物,依据路线图的步骤对肝癌做出临床诊断(如下图所示)。
1. 有乙型肝炎或丙型肝炎,或者有任何原因引起肝硬化者,至少每隔 6 个月进行一次超声及 AFP 检测,发现肝内直径≤2cm 结节,动态增强 MRI、动态增强 CT、超声造影及普美显动态增强 MRI 四项检查中至少有两项显示有动脉期病灶明显强化、门脉或延迟期强化下降的“快进快出”的肝癌典型特征,则可做出肝癌的临床诊断;对于发现肝内直径>2cm 的结节,则上述四种影像学检查中只要有一项有典型的肝癌特征,即可临床诊断为肝癌。
2. 有乙型肝炎或丙型肝炎,或者有任何原因引起肝硬化者,随访发现肝内直径≤2cm 结节,若上述四种影像学检查中无或只有一项检查有典型的肝癌特征,可进行肝穿刺活检或每 2-3 个月密切的影像学随访以确立诊断;对于发现肝内直径>2cm 的结节,上述四种影像学检查无典型的肝癌特征,则需进行肝穿刺活检以确立诊断。
3. 有乙型肝炎或丙型肝炎,或者有任何原因引起肝硬化者,如 AFP 升高,特别是持续增高,应该进行上述四种影像学检查以确立肝癌的诊断,如未发现肝内结节,在排除妊娠、活动性肝病、生殖胚胎源性肿瘤以上消化道癌的前提下,应该密切随访 AFP 水平以及每隔 2-3 个月一次的影像学复查。 [2]
医学治疗
 肝癌肝癌治疗领域的特点是多种方法、多个学科共存,而以治疗手段的分科诊疗体制与实现有序规范的肝癌治疗之间存在一定的矛盾。因此肝癌诊疗须 重视多学科诊疗团队的模式,从而避免单科治疗的局限性,为病人提供一站式医疗服务、促进学科交流,并促进建立在多学科共识基础上的治疗原则和 指南。合理治疗方法的选择需要有高级别循证依据支持,但也需要同时考虑地区和经济水平差异。
肝癌肝癌治疗领域的特点是多种方法、多个学科共存,而以治疗手段的分科诊疗体制与实现有序规范的肝癌治疗之间存在一定的矛盾。因此肝癌诊疗须 重视多学科诊疗团队的模式,从而避免单科治疗的局限性,为病人提供一站式医疗服务、促进学科交流,并促进建立在多学科共识基础上的治疗原则和 指南。合理治疗方法的选择需要有高级别循证依据支持,但也需要同时考虑地区和经济水平差异。
(一)肝切除术:
肝癌的外科治疗是肝癌病人获得长期生存最重要的手段,主要包括肝切除术和肝移植术。
1.肝切除术的基本原则:
1)彻底性:完整切除肿瘤,使切缘无残留肿瘤;
2)安全性:保留有足够功能肝组织(具有良好血供以及良好的血液和胆汁回流)以术后肝功能代偿,降低手术死亡率及手术并发症。
2.术前肝功能储备的评估:
在术前应对病人的全身情况及肝功能储备进行全面评价:常采用美国东部肿瘤协作组提出的功能状态评分(ECOG PS)来评估病人的全身 情况;采用 Child-Pugh 评分、吲哚氰绿(ICG)清除试验或瞬时弹性成像测定肝脏硬度评价肝功能储备情况;如预期保留肝组织体积较 小,则采用 CT 和/或 MRI 测定剩余肝的体积,并计算剩余肝体积占标准化肝脏体积的百分比。一般认为 Child-Pugh A 级、ICG15<20%-30% 是实施手术切除的必要条件;余肝体积须占标准肝体积的 40%以上(肝硬化病人),或 30%以上(无肝硬化病人)也是实施手术切除的必要条 件。
3.肝癌切除的适应证:
1)肝脏储备功能良好的 Ia 期、Ib 期和 IIa 期肝癌是手术切除的首选适应证,尽管有以往研究显示对于直径≤3cm 肝癌,切除和射频消融疗 效无差异,但最近的研究显示外科切除的远期疗效更好。
2)在部分 IIb 期和 IIIa 期肝癌病人中,手术切除有可能获得比其他治疗方式更好的效果,但需更为谨慎的术前评估。对 于多发性肝癌,相关研究显示,在满足手术安全性的条件下,肿瘤数目≤3 枚的多发性肝癌病人可能从手术获益;若肿瘤数 目>3 枚,即使已手术切除,在多数情况下其疗效也并不优于 TACE 等非手术治疗。
3)对于其它 IIb 期和 IIIa 期肝癌,如有以下情况也可考虑手术切除,如肿瘤数目>3 枚,但肿瘤局限在同一段或同侧半肝者,或可同时行术中射频消融处理切除范围外的病灶;合并门静脉主干或分支癌栓者,若肿瘤局限于半肝,且预期术中癌栓可完整切除或取净,可考虑手术切除 肿瘤并经门静脉取栓,术后再结合 TACE、门静脉化疗或其他全身治疗措施;如合并胆管癌栓且伴有梗阻性黄疸,肝内病灶亦可切除的病人; 伴有肝门部淋巴结转移者,切除肿瘤的同时行淋巴结清扫或术后外放射治疗;周围脏器受侵犯,但可一并切除者。 此外,对于术中探查不适宜切除的肝癌,可考虑术中肝动脉结扎(已少用,有时用于肝癌破裂出血时的手术止血)和(或)肝动脉、门静脉 插管化疗、或术中其他的局部治疗措施等。
4. 肝癌根治性切除标准:
1)术中判断标准:①肝静脉、门静脉、胆管以及下腔静脉未见肉眼癌栓;②无邻近脏器侵犯,无肝门淋巴结或远处转移;③肝脏切缘距肿 瘤边界>1cm;如切缘< 1cm,但切除肝断面组织学检查无肿瘤细胞残留,即切缘阴性。 2)术后判断标准:①术后 2 个月行超声、CT、MRI(必须有其中两项)检查未发现肿瘤病灶;②如术前 AFP 升高,则要求术后 2 个月 AFP 定量测定,其水平在正常范围(极个别病人 AFP 降至正常的时间超过 2 个月)。
5.手术切除技术:
常用的肝切除主要是包括入肝和出肝血流控制技术、肝脏离断技术以及止血技术。手术技术方面,有经验的医师可开展腹腔镜或机器人辅 助微创肝切除术。微创手术具有创伤小和术后恢复快等优点,但其长期疗效仍需要与传统的开腹手术进行前瞻性的多中心的随 机对照研究。经腹腔镜行肝癌切除的指征:①病变位于 CouinaudII、III、IVb、V、VI 段;②病变大小以不影响第一和第二肝门的解剖为准,一般不超过 10cm;③有丰富经验的医师可逐步开展腹腔镜半肝切除、肝 3 叶切除和 CouinaudI、VII、VIII 段肝切除。
切除范围较大导致余肝体积过少或顾忌余肝的功能,是阻碍根治性切除的主要原因。为了提高肝癌的可切除性,可采用如下方法:
1)术前 TACE 可使部分病人的肿瘤缩小后再切除;
2)经门静脉栓塞(Portal vein thrombosis,PVE)或门静脉结扎(Portal vein ligation,PVL)主瘤所在半肝,使余肝代偿性增大后再切除。 临床报告其并发症不多,因需 4-6 周时间等待对侧肝组织体积增大,为减少等待期间肿瘤进展的风险,可考虑与 TACE 联合。
3)联合肝脏分隔和门静脉结扎的二步肝切除术(Associating liver partition and portal vein ligation for staged hepatectomy,ALPPS)是近年发 展的新技术,适合于预期残余肝脏体积占标准肝体积不足 30%-40%的病人,经过 I 期的肝脏分隔或离断和患侧门静脉分支结扎后,健侧剩余 肝脏体积(future liver reserve, FLR)一般在 1-2 周后增生 30%-70%以上,FLR 占标准肝脏体积至少 30%以上,可接受安全的 II 期切除。术前评估非常重要,需要考虑肝硬化的程度、病人年龄、短期承受两次手术的能力和肿瘤快速进展的风险;此外可借助腹腔镜技术或消融技术等 降低二次手术的创伤。ALPPS 的禁忌证:①存在不可切除的肝外转移灶;②严重的门静脉高压症;③全身麻醉高风险病人以及一般状况较差 不能耐受大手术的病人;④I 期手术后 FLR 中有肉眼可见肝癌结节。ALPPS 应用可在短期内提高肝癌的切除率,但同时也存在高并发症发生率 及死亡率,应谨慎、合理地选择手术对象。
4)对于开腹后探查发现肝硬化较重、肿瘤位置深在、多结节的肿瘤,术中消融可降低手术风险。 解剖性切除与非解剖性切除均为常用的手术技术。对于巨大肿瘤,可采用不游离肝周韧带的前径路肝切除法。对于多发性肿瘤,可采用手术切除结合术中消融(如术中射频等)方式治疗,切除肝脏边缘肿瘤,消融深部肿瘤。对于门静脉癌栓者,行门静脉取栓术时应暂时阻断健 侧门静脉血流,防止癌栓播散。对于肝静脉癌栓或腔静脉癌栓者,可行全肝血流阻断,尽可能整块去除癌栓。合并右心房癌栓者,可开胸 切开右心房取出癌栓,同时切除肝肿瘤。合并腔静脉或右心房癌栓时手术风险较大,应慎重选择。对于肝癌伴胆管癌栓者,在去除癌栓的同时, 若肿瘤已部分侵犯胆管壁,则应同时切除受累胆管并重建胆道,以降低局部复发率。
6. 术前治疗:
对于不可切除肝癌,肝动脉结扎插管、TACE、外放射等治疗可能导致肿瘤降期从而使部分病人获得手术切除的机会,降期后切除的肝癌 病人可能获得较好的长期生存效果。对于可切除肝癌,术前 TACE 并不能改善病人生存。
7.术后治疗(转移复发的防治):
肝癌手术切除后 5 年肿瘤复发转移率高达 40%-70%,这与术前可能已存在微小播散灶或者多中心发生有关,故所有病人术后需要接受密切 随访。一旦发现肿瘤复发,根据肿瘤复发的特征,可以选择再次手术切除、局部消融、TACE、放疗或系统治疗等,延长病人生存期。对于高 危复发者,有临床研究证实术后 TACE 治疗有一定的效果,能发现并控制术后肝内微小残癌,但该结论需要进一步证实。此 外,对于伴有门静脉癌栓病人术后经门静脉置管化疗联合肝动脉化疗栓塞,也可延长病人生存。尽管有临床随机研究提示,干扰素 α 可减少 复发延长生存,但仍存争议,目前仅推荐应用于合并慢性乙肝背景的肝癌术后病人。有报道发现肝癌 miR-26a 表达与干扰 素 α 辅助治疗的疗效相关,该结果也需要进一步多中心随机对照证实。亦有大会报道,国内多中心随机平行对照研究结果表明,中药槐耳颗 粒对肝癌根治性切除术后的病人有一定的预防复发转移作用。
(二)肝移植术
1.肝癌肝移植适应证:
肝移植是肝癌根治性治疗手段之一,尤其适用于有失代偿肝硬化背景、不适合切除的小肝癌病人。合适的适应证是提高肝癌肝移植疗效, 保证宝贵的供肝资源得到公平合理应用的关键。
关于肝移植适应证,国际上主要采用米兰(Milan)标准,美国加州大学旧金山分校(UCSF)标准等。国内尚无统一标准,已有多家单位 和学者陆续提出了不同的标准,包括杭州标准、上海复旦标准、华西标准 和三亚共识等。各家标准对于无大血管侵犯、淋巴结转移及 肝外转移的要求都比较一致,但是对于肿瘤的大小和数目的要求不尽相同。上述国内标准均不同程度的扩大了肝癌肝移植的适用范围,可使更 多的肝癌病人因肝移植手术受益,并未明显降低术后总体生存率和无瘤生存率。但仍需多中心协作研究以支持和证明,从而获得高级别的循证 医学证据。经专家组充分讨论,现阶段本规范推荐采用 UCSF 标准。
2.肝癌肝移植术后复发的预防:
肝癌肝移植术后的肿瘤复发明显减低了移植后生存率。其危险因素包括肿瘤分期、血管侵犯、AFP 水平、免疫抑制剂累积用药剂量量等。 减少移植后早期钙调磷酸酶抑制剂的用量可能降低肿瘤复发率。肝癌肝移植采用 mTOR 抑制剂的免疫抑制方案亦可能预防肿 瘤复发,提高生存率,但尚需多中心随机临床研究的进一步证实。
(三)局部消融治疗
尽管外科手术是肝癌的首选治疗方法,但因肝癌病人大多合并有肝硬化,或者在确诊时大部分病人已达中晚期,能获得手术切除机会的病人约 20%-30%。近年来广泛应用的局部消融治疗,具有创伤小、疗效确切的特点,使一些不耐受手术切除的肝癌病人亦可获得根治的机会。
局部消融治疗是借助医学影像技术的引导对肿瘤靶向定位,局部采用物理或化学的方法直接杀灭肿瘤组织的一类治疗手段。主要包括射频消融 (Radiofrequency ablation,RFA)、微波消融(Microwave ablation,MWA)、冷冻治疗、高功率超声聚焦消融(High power focused ultrasound ablation,HIFU) 以及无水乙醇注射治疗(Percutaneous ethanol injection,PEI)等。局部消融最常用超声引导,具有方便、实时、高效的特点。CT 及 MRI 结合多模态影像 系统可用于观察超声无法探及的病灶。CT 及 MRI 引导技术还可应用于肺、肾上腺、骨等转移灶的消融等。
消融的路径有经皮、腹腔镜、或开腹三种方式。大多数的小肝癌可以经皮穿刺消融,具有经济、方便、微创的特点。位于肝包膜下的肝癌,特别是 突出肝包膜外的肝癌,经皮穿刺消融风险较大,或者影像学引导困难的肝癌,可考虑经开腹消融和经腹腔镜消融的方法。
局部消融治疗适用于单个肿瘤直径≤5cm;或肿瘤结节不超过 3 个、最大肿瘤直径≤3cm;无血管、胆管和邻近器官侵犯以及远处转移,肝功能分级为 Child-Pugh A 或 B 级的肝癌病人,可获得根治性的治疗效果。对于不能手术切除的直径 3-7cm 的单发肿瘤或多发肿瘤,可联合 TACE 。
1. 常见消融手段包括:
1)RFA:是肝癌微创治疗的最具代表性消融方式,其优点是操作方便,住院时间短,疗效确切,花费相对较低,特别适用于高龄病人。对于直径≤3cm 肝癌病人,RFA 的无瘤生存率略逊于手术切除。与 PEI 相比,RFA 具有根治率高、所需治疗次数少和远期生存率高的显著优势。RFA 治疗的精髓是对肿瘤整体灭活并尽量减少正常肝组织损伤,其前提是对肿瘤浸润范围和卫星灶的确认。因此,十分强调治疗前精确的影像学检查。超声 造影技术有助于确认肿瘤的实际大小和形态,界定肿瘤浸润范围,检出微小肝癌和卫星灶,为制定消融方案灭活肿瘤提供了可靠的参考依据。
2)MWA:是我国常用的热消融方法,在局部疗效、并发症发生率以及远期生存方面与 RFA 相比都无显著差异。其特点是消融效率高,避免 RFA 所存 在的“热沉效应”。现在的 MWA 技术也能一次性灭活肿瘤,血供丰富的肿瘤,可先凝固阻断肿瘤主要滋养血管,再灭活肿瘤,可以提高疗效。建立温度 监控系统可以调控有效热场范围,保证凝固效果。随机对照研究显示,两者之间无论是在局部疗效和并发症方面,还是生存率方面都无统计学差异,MWA 和 RFA,这两种消融方式的选择可根据肿瘤的大小、位置,选择更适宜的消融方式。
3)PEI:适用于直径≤3cm 以内肝癌的治疗,局部复发率高于 RFA,但 PEI 对直径≤2cm 的肝癌消融效果确切,远期疗效类似于 RFA。PEI 的优点是 安全,特别适用于癌灶贴近肝门、胆囊及胃肠道组织,而热消融治疗(RFA 和 MWA)可能容易造成损伤的情况下。
2. 基本技术要求需要注意以下方面:
1) 操作医师必须经过严格培训和足够的实践积累,治疗前应该全面而充分地评估病人的全身状况,肝功能状态,肿瘤的大小、位置、数目等。要注意肿 瘤与邻近器官的关系,制定合理的穿刺路径及消融范围,在保证安全的前提下,达到足够的安全范围。
2) 根据肿瘤的大小、位置,强调选择适合的影像引导技术(超声或 CT)和消融手段(RFA、MWA 或 PEI)。
3) 肿瘤距肝门部肝总管、左右肝管的距离应至少为 5mm。不推荐对>5cm 的病灶单纯施行消融治疗。对于多个病灶或更大的肿瘤,根据病人肝功能状 况,采取治疗前 TACE+消融联合治疗,效果优于单纯的消融治疗。
4) 消融范围应力求包括 5mm 的癌旁组织,以获得“安全边缘”,彻底杀灭肿瘤。对于边界不清晰、形状不规则的浸润型癌或转移癌灶,在邻近肝组织及 结构条件许可的情况下,建议适当扩大消融范围。
3. 对于直径≤5cm 的肝癌治疗选择:
数项临床前瞻性随机对照和系统回顾性分析显示,手术切除宜首选。在临床实践中,应该根据病人的一般状况和肝功能,肿瘤 的大小、数目、位置决定,以及从事消融治疗的医师的技术和经验,全面考虑后选择合适的初始治疗手段。通常认为,如果病人能够耐受肝切除术,以 及肝癌位置表浅或位于肝脏边缘,应首选手术切除。局部消融可作为手术切除之外的另一种治疗选择。对于 2-3 个癌灶位于不同区域、或者位居肝脏深部 或中央型≤5cm 的肝癌,局部消融可以达到手术切除疗效,获得微创下根治性消融。
4. 肝癌消融治疗后应重视的评估和随访:
评估局部疗效的规范方法是在消融后 1 个月左右,复查肝脏动态增强 CT 或 MRI,或者超声造影,以评价消融效果。消融效果可分为:①完全消融 (Complete response,CR):经动态增强 CT 或 MRI 扫描,或者超声造影随访,肿瘤所在区域为低密度(超声表现为高回声),动脉期未见强化;②不完 全消融(In-complete response,ICR):经动态增强 CT 或 MRI 扫描,或者超声造影随访,肿瘤病灶内局部动脉期有强化,提示有肿瘤残留。对治疗后有肿 瘤残留者,可以进行再次消融治疗;若 2 次消融后仍有肿瘤残留,视为消融治疗失败,应放弃消融疗法,改用其他疗法。完全消融后应定期随访复查, 通常情况下每隔 2~3 月复查肿瘤标志物、彩超、MRI 或 CT,以便及时发现可能的局部复发病灶和肝内新发病灶,利用经皮消融微创安全和简便易于反复施行的优点,有效地控制肿瘤进展。
(四)TACE 治疗
TACE 治疗在国内亦称介入疗法、介入治疗 Interventional treatment ),目前被公认为肝癌非手术治疗的最常用方法之一。
1.基本原则:
1)要求在数字减影血管造影机下进行;
2)必须严格掌握临床适应证;
3)必须强调超选择插管至肿瘤的供养血管内治疗;
4)必须强 调保护病人的肝功能;
5)必须强调治疗的规范化和个体化;
6)如经过 4-5 次 TACE 治疗后,肿瘤仍继续进展,应考虑换用或联合其它治 疗方法,如外科手术、局部消融和系统治疗以及放疗等。
2.适应证:
1)IIb 期、IIIa 期和 IIIb 期的部分病人,肝功能分级 Child-PughA 或 B 级,ECOG 评分 0-2;
2)可以手术切除,但由于其他原因(如高龄、 严重肝硬化等)不能或不愿接受手术的 Ib 期和 IIa 期病人;
3)多发结节型肝癌;
4)门静脉主干未完全阻塞,或虽完全阻塞但肝动脉与门 静脉间代偿性侧支血管形成;
5)肝肿瘤破裂出血或肝动脉-门脉静分流造成门静脉高压出血;
6)控制局部疼痛、出血以及栓堵动静脉瘘;
7)肝癌切除术后,DSA 造影可以早期发现残癌或复发灶,并给予介入治疗。
3.禁忌证:
1)肝功能严重障碍(Child-Pugh C 级),包括黄疸、肝性脑病、难治性腹水或肝肾综合征;
2)凝血功能严重减退,且无法纠正;
3) 门静脉主干完全被癌栓栓塞,且侧支血管形成少;
4)合并活动性肝炎或严重感染且不能同时治疗者;
5)肿瘤远处广泛转移,估计生存期 <3 个月者;
6)恶液质或多器官功能衰竭者;
7)肿瘤占全肝比例≥70%癌灶(如果肝功能基本正常,可考虑采用少量碘油乳剂分次栓塞);
8)外周血白细胞和血小板显著减少,白细胞<3.0×109 /L(非绝对禁忌,如脾功能亢进者,与化疗性白细胞减少有所不同),血小板<50×109 /L;
9)肾功能障碍:肌酐>2mg/dl 或者肌酐清除率<30ml/min。
4. 操作程序要点和分类:
1)肝动脉造影,通常采用 Seldinger 方法,经皮穿刺股动脉插管,导管置于腹腔干或肝总动脉行 DSA 造影,造影图像采集应包括动脉期、 实质期及静脉期;应做肠系膜上动脉造影、注意寻找侧枝供血。仔细分析造影表现,明确肿瘤的部位、大小、数目以及供血动脉。
2)根据肝动脉插管化疗、栓塞操作的不同,通常分为:①肝动脉灌注化疗:经肿瘤供血动脉灌注化疗,常用化疗药物有蒽环类、铂类等。②肝 动脉栓塞:单纯用栓塞剂堵塞肝肿瘤的供血动脉。③肝动脉化疗栓塞:把化疗药物与栓塞剂混合在一起,经肿瘤的供血动脉支注入。TACE 治 疗最常用的栓塞剂就是碘油乳剂、标准化明胶海绵颗粒,还有药物洗脱微球。先灌注一部分化疗药物,一般灌注时间不应<20 min。然后将另 一部分化疗药物与碘油混合成乳剂进行栓塞。碘油用量一般为 5-20 ml,不超过 30 ml。在透视监视下依据肿瘤区碘油沉积是否浓密、瘤周是否 已出现门静脉小分支影为界限。在碘油乳剂栓塞后加用颗粒性栓塞剂(如:标准化明胶海绵颗粒、微球、聚乙烯醇颗粒等)。提倡使用超液化 乙碘油与化疗药物充分混合成乳剂,尽量避免栓塞剂返流栓塞正常肝组织或进入非靶器官。栓塞时应尽量栓塞肿瘤的所有供养血管,以尽量使肿瘤去血管化。
5. TACE 术后常见不良反应:
栓塞后综合症,是 TACE 治疗的最常见不良反应,主要表现为发热、疼痛、恶心和呕吐等。发热、疼痛的发生原因是肝动脉被栓塞后引起 局部组织缺血、坏死,而恶心、呕吐主要与化疗药物有关。此外,还有穿刺部位出血、白细胞下降、一过性肝功能异常、肾功能损害以及排尿 困难等其他常见不良反应。介入治疗术后的不良反应会持续 5-7 天,经对症治疗后大多数病人可以完全恢复。
6.疗效评价:
根据实体瘤 mRECIST 评价标准以及 EASL 评价标准评估肝癌疗效,长期疗效指标为病人总生存时间(Overall survival, OS);短期疗效: 评价指标为肿瘤的影像学应答和手术至疾病进展时间(Time to progress,TTP)。
7.影响 TACE 远期疗效的主要因素包括:1)肝硬化程度、肝功能状态;2)血清 AFP 水平;3)肿瘤的容积和负荷量;4)肿瘤包膜是否完整;5)门静脉有无癌栓;6) 肿瘤血供情况;7)肿瘤的病理分型。
8.随访及 TACE 间隔期间治疗:
一般建议第一次 TACE 治疗后 3-6 周时复查 CT 和/或 MRI、肿瘤相关标志物、肝肾功能和血常规检查等;若影像学检查显示肝脏的瘤灶内的碘油沉积浓密、瘤组织坏死并且无增大和无新病灶,暂时不做 TACE 治疗。至于后续 TACE 治疗的频率应依随访结果而定,主要包括病人对 上一次治疗的反应、肝功能和体能状况的变化。随访时间可间隔 1-3 个月或更长时间,依据 CT 和/或 MRI 动态增强扫描评价肝脏肿瘤的存活情 况,以决定是否需要再次进行 TACE 治疗。目前主张综合 TACE 治疗,即 TACE 联合其它治疗方法,目的是控制肿瘤、提高病人生活质量和让 病人带瘤长期生存。
9.TACE 治疗时注意点:
1)提倡用微导管超选择性插管。插入肿瘤的供血动脉支,精准地注入碘油乳剂和颗粒性栓塞剂,提高疗效和保护肝功能。
2)可使用门静脉内支架置放术和碘-125 粒子条或碘-125 粒子门静脉支架置放术,有效处理门静脉主干癌栓。
3)TACE 联合消融治疗:目前有两种 TACE 联合热消融治疗方式。①序贯消融:先行 TACE 治疗,术后 1-4 周内加用射频或微波消融。② 同步消融:在 TACE 治疗时,同时给予射频或微波消融,可以明显提高临床疗效,并减轻肝功能损伤。
4)颗粒性栓塞剂的应用:包括标准化明胶海绵颗粒、聚乙烯醇颗粒、微球、药物洗脱微球等。常规 TACE 常使用标准化明胶海绵微粒与碘 油联合。药物性洗脱微球(Drug-eluting beads,DEB)是一种新的栓塞剂,可携带化疗药物。文献报道 DEB 在肿瘤客观有效率及总获益率方面 具有优势。但是,近期文献报道结果显示两种方法治疗肝癌的疗效无显著性差异。
5)重视局部加局部治疗和局部联合全身治疗:①TACE 联合消融(RFA、MWA 等)治疗;②TACE 联合放射治疗:主要指门静脉主干癌栓、下腔静脉癌栓和局限性大肝癌介入治疗后的治疗;③TACE 联合 II 期外科手术切除:大肝癌或巨块型肝癌在 TACE 治疗后缩小并获得手术机会时,推荐外科手术切除;④TACE 联合全身治疗:包括联合分子靶向药物三氧化二砷、放 射免疫靶向药物、基因治疗、免疫治疗及全身化疗等。
(五)放射治疗
放射治疗(简称放疗)分为外放疗和内放疗。外放疗是利用放疗设备产生的射线(光子或粒子)从体外对肿瘤照射。内放疗是利用放射性 核素,经机体管道或通过针道植入肿瘤内。
1. 外放射治疗:
1)适应证: 对伴有门静脉/下腔静脉癌栓或肝外转移的 IIIa 期、IIIb 期肝癌病人,多属于姑息性放疗,有一部分病人肿瘤缩小或降期,可获得手术切除 机会。肝外转移包括淋巴结转移、肺转移、骨转移、肾上腺转移、脑转移、腹膜和胸腔内膜转移等,也可用于等待肝癌肝移 植前的治疗。对肝外转移的病人,外放疗可减轻疼痛、梗阻或出血等症状,使肿瘤发展减缓,从而延长生存期 。中央型肝癌 切缘距肿瘤≤1cm 的窄切缘术后可以辅助放疗。
2)照射靶区:大体肿瘤体积(Gross Tumor Volume,GTV)在增强 CT 中定义,必要时也需要参考 MRI 影像。肝癌出现淋巴引流区转移较少见,因此, 临床靶体积(Clinical Target Volume,CTV)不包括淋巴引流区。对于已经出现淋巴结转移的病人,必须包括其下一站的淋巴引流区,作为 CTV。 其余情况(如局限于肝内、癌栓、肾上腺、肺转移等)的 CTV 为影像学可见的病灶外扩 2 到 4 mm。肿瘤移动度可以通过透视评估,但 4D 模拟 CT 技术更为准确。在常规放疗技术情况下,计划靶体积(Planning Target Volume,PTV)一般在 CTV 基础上外放 5-15 mm。
肝内靶区的勾划必须有动脉相、静脉相互相参考;MRI 对肝内病灶较清楚,PET/CT 可以了解肝外病灶情况,靶区的确定尽量多种影像学 资料互相参考。肝癌放疗野设计的一个重要原则是充分利用正常肝组织所具有的强大再生能力,在设计放射野时,尤其是大肝癌,最好能保留 一部分正常肝组织不受照射,从而使部分正常肝组织能得到再生。
3)照射剂量和正常组织耐受剂量: 立体定向放疗时,肝功能为 Child-Pugh A 级,正常肝体积超过 700 ml,<15 Gy×3 次,正常肝>800 ml,<18 Gy×3 次是安全剂量;一般 推荐放疗剂量≥30-60 Gy/3-6 次。对姑息性放疗的肝癌病人,肿瘤的放疗剂量基本上取决于全肝和/或周围胃肠道的耐受量,大部分的报道 以 40-70Gy 常规分割剂量。
正常组织耐受剂量:肝功能为 Child-Pugh A 者,常规分割放疗时,全肝的耐受量为 28-30 Gy,或非常规低分割放疗(每次分割剂量 4-8 Gy)全肝的耐受量为 23 Gy。肝功能为 Child-Pugh B 者,肝脏对射线的耐受量明显下降。由于亚洲 HCC 病人常伴有肝硬化和脾功能亢进, 导致胃肠道瘀血和凝血功能差,胃肠道的放射耐受剂量低于 RTOG 推荐的剂量 。
4)放疗技术:建议应用三维适形放疗(3-D Conformal radiotherapy,CRT))、调强放疗(Intensity modulated radiation therapy ,IMRT)、图像引导放疗(Image guided radiation therapy,IGRT)或立体定向放疗(Stereotactic body radiation therapy,SBRT)。图像引导下的调强放射治疗技术优于三维适形放疗,螺旋断层放疗设备作为图像引导下的调强放疗,适合多发病灶的肝癌病人。肝癌的立体定向放射治疗必须满足以下条件:有四维 CT 的影像设备引导或肿瘤追踪系统,非常精确的病人体位固定,放射治疗前的个体化图像校正,放射治疗设备能聚焦到肿瘤以及肿瘤之外的射线 梯度下降快。目前缺乏较高级别的临床资料支持质子放疗在肝癌病人的生存率优于光子。
呼吸运动是导致肝脏肿瘤在放疗过程中运动和形变的主要原因。目前可采取多种技术以减少呼吸运动带来的影响,如门控技术、实时追踪 技术和呼吸控制技术,根据四维 CT 确定内靶区(Internal target volume,ITV)等等。腹部加压简单易行,减少肝脏的呼吸动度,压腹部位在 剑突与脐连线上半部,可最大程度减小肝脏呼吸动度。
2. 内放射治疗:
放射性粒子植入是局部治疗肝癌的一种有效方法,包括 90Y 微球疗法、131I 单克隆抗体、放射性碘化油、I125粒子植入等,放射性粒子可持续产生低能 X 射线、γ 射线或 β 射线,在肿瘤组织内或在受肿瘤侵犯的管腔(门静脉、下腔静脉或胆道)内植入放射性粒子后,通过 持续低剂量辐射,最大程度杀伤肿瘤细胞。粒子植入技术包括组织间植入、门静脉植入、下腔静脉植入和胆道内植入,分别治疗肝内病灶、门 静脉癌栓、下腔静脉癌栓和胆管内癌或癌栓。
(六)全身治疗
对于没有禁忌证的晚期肝癌病人,全身治疗可以减轻肿瘤负荷,改善肿瘤相关症状,提高生活质量,延长生存时间。
1.抗肿瘤治疗及其疗效评价:
1)分子靶向药物: 迄今为止,索拉非尼仍然是唯一获得批准治疗晚期肝癌的分子靶向药物。两项大型国际多中心 III 期临床试验均充分证明了索拉非尼对于 不同国家地区、不同肝病背景的晚期肝癌都具有一定的生存获益。常规推荐用法为 400mg,po.,bid,应用时需注意对肝功 能的影响。最常见的不良反应为腹泻、体重下降、手足综合征、皮疹、心肌缺血以及高血压等,一般发生在治疗开始后的 2-6 周内,可用于肝功能 Child A、B 级的病人。而相对于肝功能 Child B 级,ChildA 级的病人生存获益更明显。
2)系统化疗: 传统的细胞毒性药物,包括阿霉素、表阿霉素、氟尿嘧啶、顺铂和丝裂霉素等,在肝癌中的单药或传统联合用药有效率均不高,且毒副作 用大,可重复性差。一个主要原因为化疗药物不但会激活乙肝病毒复制,还会损害病人的肝功能,加重肝炎肝硬化,导致化疗无法带来生存效 益。
根据 EACH 研究后期随访的数据,含奥沙利铂的 FOLFOX4 方案在整体反应率、疾病控制率、无进展生存期、总生存期方面,均优于传统化 疗药物阿霉素,且耐受性和安全性较好。因此,奥沙利铂在我国被批准用于治疗不适合手术切除或局部治疗的局部晚期和转移性肝癌。
化疗适应证主要为:①合并有肝外转移的晚期病人;②虽为局部病变,但不适合手术治疗和 TACE 者,如肝脏弥漫性病变或肝血管变异; ③合并门静脉主干或下腔静脉瘤栓者;④多次 TACE 后肝血管阻塞和/或 TACE 治疗后复发的病人。
化疗禁忌证为:①ECOG PS 评分>2,Child-Pugh 评分>7 分;②白细胞计数<3.0 X 109 /L 或中性粒细胞计数<l.5×109 /L,血小板计数< 60×109 /L,血红蛋白<90g/L;③肝、肾功能明显异常,氨基转移酶(AST 或 ALT)>5 倍正常值和/或胆红素显著升高>2 倍正常值,血清白 蛋白<28g/L,肌酐(Cr)≥正常值上限,肌酐清除率(CCr)<50ml/min;④具有感染发热、出血倾向、中-大量腹腔积液和肝性脑病。
其他药物:三氧化二砷治疗中晚期原发性肝癌具有一定的姑息治疗作用。在临床应用时,应注意监测肝肾毒性。
3)免疫治疗: 肝癌免疫治疗主要包括免疫调节剂(干扰素 α、胸腺肽 α1(胸腺法新)等)、免疫检查点阻断剂(CTLA-4 阻断剂、PD-1/PD-L1 阻断 剂等)、肿瘤疫苗(树突细胞疫苗等)、细胞免疫治疗(细胞因子诱导的杀伤细胞,即 CIK)。这些治疗手段均有一定的抗肿瘤作用,但尚待大规模的临床研究加以验证。
4)中医药: 中医中药治疗能够改善症状,提高机体的抵抗力,减轻放化疗不良反应,提高生活质量。除了采用传统的辨证论治、服用汤剂之外,我国 药监部门业已批准了若干种现代中药制剂如槐耳颗粒、康莱特、华蟾素、榄香烯、肝复乐等用于治疗肝癌,具有一定的疗效,病人的依从性、安全性和耐受性均较好。但是,这些药物尚缺乏高级别的循证医学证据加以充分支持。
5)全身治疗的疗效评估: 对于化疗病人,仍然采用 Recist 1.1 标准,可同时参考血清学肿瘤标记(AFP)以及肿瘤坏死程度的变化,一般在治疗期间每 6-8 周进行影 像学评估,同时通过动态观察病人的症状、体征、治疗相关不良反应进行综合评估。鉴于索拉非尼、TACE 治疗很少能改变肿瘤大小,故建议采 用以肿瘤血管生成和密度改变为基础的疗效评估标准(mRecist 标准)。对于免疫治疗的评价,可参照 irRC (immune-related response criteria)标准 。
2.抗病毒治疗及其他保肝治疗:
合并有乙肝病毒感染且复制活跃的肝癌病人,口服核苷(酸)类似物抗病毒治疗非常重要。宜选择强效低耐药的药物如恩替卡韦、替比夫 定或替诺福韦脂等。TACE 治疗可能引起乙型肝炎病毒复制活跃,目前推荐在治疗前即开始应用抗病毒药物。抗病毒治疗还可以降低术后复发率。因此,抗病毒治疗应贯穿肝癌治疗的全过程。
肝癌病人在自然病程中或者治疗过程中可能会伴随肝功能异常,因此应及时适当的应用保肝药物,如异甘草酸镁注射液(甘草酸二铵肠溶 胶囊)、复方甘草酸苷、还原型谷胱甘肽、多磷脂酰胆碱等;抗炎治疗药物如广谱水解酶抑制剂乌司他丁等;利胆类药物如腺苷蛋氨酸、熊去 氧胆酸等。这些药物可以保护肝功能、提高治疗安全性、降低并发症、改善生活质量。
3.对症支持治疗:
适度的康复运动可以增强机体的免疫功能。另外,应加强对症支持治疗,包括在晚期肝癌病人中的积极镇痛、纠正贫血、纠正低白蛋白血 症、加强营养支持,控制合并糖尿病病人的血糖,处理腹水、黄疸、肝性脑病、消化道出血等伴随症状。 对于晚期肝癌病人,应理解病人者及家属的心态,采取积极的措施调整其相应的状态,把消极心理转化为积极心理,通过舒缓疗护让其享 有安全感、舒适感而减少抑郁与焦虑。[2]
康复保健
恐惧:
 肝癌1、评估病人恐惧的表现,协助病人寻找恐惧的原因。
肝癌1、评估病人恐惧的表现,协助病人寻找恐惧的原因。
2、加强心理护理,向病人解释保持乐观情绪的重要性。
3、为病人创造安全、舒适的环境:
1)多与病人交谈,但应避免自己的情绪反应与病人情绪反应相互起反作用。
2)帮助病人尽快熟悉环境。
3)用科学、熟练、安全的技术护理病人,以取得病人信任。
4)减少对病人感觉的不良刺激,如限制病人与其他恐惧情绪病人或家属接触。
4、帮助病人减轻情绪反应:
1)鼓励病人诉说自己的感觉。
2)护士应理解、同情病人,耐心倾听其诉说,帮助其树立战胜疾病的信心。
3)分散病人的注意力,如听音乐、相声、默默数数、与人交谈等。
4)消除对病人产生干扰的因素,如解决失眠等问题。
5、帮助病人正确估计目前病情,以配合治疗及护理。
疼痛:
1、观察、记录疼痛的性质、程度、伴随症状,评估诱发因素,并告之病人。
2、加强心理护理,给予精神安慰。
3、咳嗽、深呼吸时用手按压伤口。
4、妥善固定引流管,防止引流管来回移动所引起的疼痛。
5、严重时注意生命体征的改变及疼痛的演变。
6、指导病人使用松弛术、分散注意力等方法,如听音乐、相声或默默数数,以减轻病人对疼痛的感受性,减少止痛药物的用量。
7、在疼痛加重前,遵医嘱给予镇痛药,并观察、记录用药后的效果。
8、教给病人用药知识,如药物的主要作用、用法,用药间隔时间,疼痛时及时用止痛药效果最好。
营养失调:
1、向病人解释摄取营养物质的重要意义,指导病人采取合理的饮食结构,给予高热量、适量蛋白、高维生素、低脂、易消化的饮食,少量多餐,避免刺激性食物。
2、采取增加食欲的措施:
1)选择病人爱好的适合病情的食物品种,并经常更换,烹调时注意色、香、味及营养成分。
2)创造良好的进食环境,如空气清新、安静,及时清理呕吐物。
3、进食前、进食时不做引起疼痛和不适的治疗、护理和检查。
4、遵医嘱给予助消化药及护肝药。
5、遵医嘱给予营养支持:静脉高价营养(胃肠外营养)、要素饮食(胃肠道营养),其护理参见有关章节。
6、定期给病人测体得,了解营养状况。
7、监测血红蛋白,必要时可少量输血、白蛋白。
有感染的危险
1、评估引起感染的潜在危险因素,并告之病人等,使其配合治疗、护理。
2、加强皮肤护理,保持床铺清洁、干燥,每2小时协助病人翻身1次,以预防皮肤破损而诱发感染。
3、禁食期间加强口腔护理,每天2-3次,预后口腔感染。
4、加强营养,给予全身支持疗法,如输新鲜血、氨基酸等,以增强机体防御功能和组织修复能力。
5、在进行换药、治疗、护理处置时,严格遵守无菌操作替程,切断感染源。
6、保持各引流管畅通,观察并记录引流物的性质及量,必要时做细菌培养,一般24-48小时拔除切口引流管,以预防腹腔感染。
7、嘱病人不可随意揭开或用手触摸伤口,以防污染伤口。
8、演示有效咳嗽方法,并指导病人咳嗽时采取预防切口疼痛的措施。
9、按医嘱合理使用抗生素,预防和控制感染发生。
10、指导病人识别感染的前兆症状,以便及时报告,尽早发现感染迹象。
11、观察体温、脉搏、呼吸和血压等变化,注意有无感染的迹象,若术后72小时后,体温异常升高到38℃持续不降,则是感染的迹象,应报告医师确定感染部位,并及时处理。
潜在并发症--腹腔内出血
1、术前护理:防止癌肿破裂出血。
1)术前全面检查肝功能和凝血功能,如有出血倾向和低血浆蛋白者,遵医嘱执行全身支持和保肝治疗,以及给予改善凝血功能的药物。
2)术前3天即应肌内注射维生素K110mg,每天2次。
3)告诉病人避免精神紧张、剧烈活动,防止癌肿破裂出血。
4)让病人了解癌肿破裂出血时的腹部症状,如出现剧烈腹痛时,应立即告知医护人员,以免延误治疗。
5)如肝区疼痛突然加剧,且出现腹膜刺激症状和休克时,则提示为癌肿破裂致急性大出血,应配合医师抢救,并作好手术准备。
6)严密观察生命体征及神志改变。
2、术后护理:
1)术后第2天给予半卧位,但要避免过早活动,以免肝断面出血。
2)监测生命体征,术后每30分钟1次,平稳后每2-4小时1次。
3)严格执行补液、补血、抗感染治疗。
4)术后保持肝部引流管通畅,观察和记录引流液色、量和性质,若疑有活动性出血,立即通知医师处理,并做好再次手术的准备。
5)心理护理:出血时关心和安慰病人,告诉病人不良心理状态可加重病情,不利于止血;帮助病人消除紧张、恐惧心理。
潜在并发症--肝昏迷
1、密切观察意识状况,注意有无精神错乱、自我照顾能力降低、性格改变和行为失常等肝昏迷前期症状。
2、饮食护理:禁食高蛋白饮食,给予以碳水化合物为主的食物,保证水、电解质和其他营养的平衡。
3、绝对卧床休息,避免剧烈运动,防止癌肿破裂出血。
4、密切观察血压、脉搏及腹部情况,以及早发现腹腔内出血。
5、术前3 天即应给病人进行肠道准备,口服链霉素0.5,每天2次,或新霉素1.0,每天4次,以抑制肠细菌。术前晚温开水清洁灌肠,以减少血氨的来源和消除术后可能诱发肝昏迷的因素,禁用肥皂水灌肠。
6、半肝以上切除病人术后间歇给氧3-4天,以保护肝细胞,并严格执行保肝治疗,防止肝昏迷。
疾病预防
 肝癌迄今尚缺乏一种能够适用于所有肝癌患者统一固定的治疗方案,所以肝癌的治疗应该个体化,在每一例肝癌患者的治疗中,都需要外科、影像科、介入科、肿瘤内科等多学科相互补充和有机结合。早期治疗方案的选择将极大影响肝癌患者的预后。因此,早期发现、早期诊断、早期治疗和预防工作显得尤为重要。
肝癌迄今尚缺乏一种能够适用于所有肝癌患者统一固定的治疗方案,所以肝癌的治疗应该个体化,在每一例肝癌患者的治疗中,都需要外科、影像科、介入科、肿瘤内科等多学科相互补充和有机结合。早期治疗方案的选择将极大影响肝癌患者的预后。因此,早期发现、早期诊断、早期治疗和预防工作显得尤为重要。
对肝癌高危人群的筛查,有助于早期发现、早期诊断、早期治疗,是提高肝癌疗效的关键。在我国,肝癌的高危人群主要包括:具有乙型肝炎病毒(Hepatitis B virus,HBV)和/或丙型肝炎病毒(Hepatitis C virus,HCV)感染、长期酗酒、非酒精脂肪性肝炎、食用被黄曲霉毒素污染食物、各种原因引起的肝硬化、以及有肝癌家族史等的人群,尤其是年龄 40 岁以上的男性风险更大。血清甲胎蛋白(Alpha-fetoprotein,AFP)和肝脏超声检查是早期筛查的主要手段,建议高危人群每隔 6 个月进行至少一次检查。
在日常生活中要注意以下几点:
1、避免情绪波动,保持乐观的精神状态,应尽量避免或减少引起情绪波动的各种刺激活动;
2、避免过度劳累:过度的脑力或体力劳动不仅可使肝癌患者机体的抵抗力降低,促使癌症的复发或转移,而且可加重肝功损害,导致病情恶化;
3、戒除不良的生活方式或习惯:忌烟忌酒,不吃霉变的粮食,少吃腌制肉制品等;
4、生活规律,日常起居,户外活动,饮食营养,身体锻炼,规律化;
5、避免感染乙肝和丙肝。肝癌的防治任重而道远。
建议:
1、对于有乙肝、丙肝等肝病病史的患者应该定期复查血AFP水平和肝脏B超,对肝癌做到早发现、早诊断、早治疗。
2、对于肝炎基础上发展而来肝癌患者,应注重抗病毒治疗的重要性,尽早抗病毒治疗能有效控制肝癌的进展。
3、一旦确诊肝癌,应根据肿瘤的大小、部位、有无肝内外转移及患者全身情况选择合理的肝癌个体化治疗方案。目前手术切除仍然是肝癌治疗的最有效手段。多模式的综合治疗和多学科团队联合诊疗能明显改善患者的预后。
4、肝移植是一种有效根治肝癌的手段,尤其适用于合并肝硬化,肝功能失代偿的小肝癌患者,但对于晚期肝癌应严格把握其适应证。
5、肝癌手术后定期复查非常重要,应定期进行影像学检查以及动态检测AFP变化。
随访
对于肝癌患者,强调通过动态观察患者的症状、体征和辅助检查(主要是血清AFP和影像学检查)进行定期随访,应当监测疾病发展、复发或治疗相关不良反应。一般认为,随访频率在治疗后3年内应该每3~4个月一次;3~5年期间,每4~6个月一次;5年后依然正常,可以改为6~12个月一次。
增加谷物摄入量
2019年2月,哈佛医学院等研究机构纳入约12万名受试者随访研究发现,多吃全谷物与肝细胞癌风险降低相关,全谷物吃得最多的人群与吃得最少的人群相比,肝细胞癌风险显著降低37%。该研究发表于《JAMA Oncology》。[3]
临床治疗
 肝癌2018年4月,我国首个反义核酸药物“注射用CT102”进入临床试验研究,注射用CT102有望为肝癌患者提供一种全新的基因靶向治疗手段。[4]
肝癌2018年4月,我国首个反义核酸药物“注射用CT102”进入临床试验研究,注射用CT102有望为肝癌患者提供一种全新的基因靶向治疗手段。[4]
科学研究
2019年1月,一项研究表明,使用遗传学方法或者一种在研药物抑制PD-L1蛋白的合成,在肝癌的小鼠模型中不但延缓了肿瘤的生长,而且成功阻断了肿瘤逃避免疫反应的能力。这项研究发表于《Nature Medicine》上,可能为治疗肝癌带来新的药物开发策略。[5]

-
肝癌转移复发的基础与临床
2025-06-13 19:04:12 查看详情


 求购
求购