- 丙烯酰胺

丙烯酰胺
理化性质
物理性质
丙烯酰胺是一种白色晶体物质,别名AM,其单体为无色透明片状结晶,沸点125℃(3325Pa),熔点84~85℃,密度1.122g/cm3。能溶于水、乙醇、乙醚、丙酮、氯仿,不溶于苯及庚烷中。
化学性质
别名:2-丙烯酰胺,丙烯醯胺050-01,丙烯酰胺水合液,AM2-丙烯酰胺,98+%丙烯酰胺,ELECTROPHORESIS GRADE,99+%丙烯酰胺。
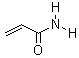 丙烯酰胺结构图
丙烯酰胺结构图
CAS NO.:79-06-1
EINECS:201-173-7
InChI=1/C3H5NO/c1-2-3(4)5/h2H,1H2,(H2,4,5)
结构式:CH2=CHCONH2
分子式:C3H5NO
分子量:71.08
丙烯酰胺是一种不饱和酰胺,在酸碱环境中可水解成丙烯酸,是有机合成材料的单体,生产医药、染料、涂料的中间体。丙烯酰胺单体在室温下很稳定,但当处于熔点或以上温度、氧化条件以及在紫外线的作用下很容易发生聚合反应。当加热使其溶解时,丙烯酰胺释放出强烈的腐蚀性气体和氮的氧化物类化合物。
室温下稳定,但熔融时则骤然聚合。易燃,受高热分解放出腐蚀性气体。毒性很大,LD50 126mg/kg。对中枢神经系统有危害,且可能致癌,对眼睛和皮肤亦有强烈的刺激作用。1974年日本福冈县曾发生丙烯酰胺中毒事件。空气中允许接触限:美国TWA为0.3mg/m^3(ACGIH),水中0.02~0.07mg/L。
分布情况
丙烯酰胺主要在高碳水化合物、低蛋白质的植物性食物加热(120°C 以上)烹调过程中形成。140-180℃为生成的最佳温度,而在食品加工前检测不到丙烯酰胺;在加工温度较低,如用水煮时,丙烯酰胺的水平相当低。水含量也是影响其形成的重要因素,特别是烘烤、油炸食品最后阶段水分减少、表面温度升高后,其丙烯酰胺形成量更高;但咖啡除外,在焙烤后期反而下降。丙烯酰胺的主要前体物为游离天门冬氨酸(土豆和谷类中的代表性氨基酸)与还原糖,二者发生Maillard反应生成丙烯酰胺。食品中形成的丙烯酰胺比较稳定;但咖啡除外,随着储存时间延长,丙烯酰胺含量会降低。
既然丙烯酰胺的形成与加工烹调方式、温度、时间、水分等有关,因此不同食品加工方式和条件不同,其形成丙烯酰胺的量有很大不同,即使不同批次生产出的相同食品,其丙烯酰胺含量也有很大差异。在JECFA 64次会议上,从24个国家获得的2002-2004年间食品中丙烯酰胺的检测数据共6,752个,其中67.6%的数据来源于欧洲,21.9%来源于南美,8.9%的数据来源于亚洲,1.6%的数据来源于太平洋。检测的数据包含早餐谷物、土豆制品、咖啡及其类似制品、奶类、糖和蜂蜜制品、蔬菜和饮料等主要消费食品,其中含量较高的三类食品是:高温加工的土豆制品(包括薯片、薯条等),平均含量为0.477mg/kg,最高含量为5.312mg/kg;咖啡及其类似制品,平均含量为0.509mg/kg,最高含量为7.3mg/kg;早餐谷物类食品,平均含量为0.313mg/kg,最高含量为7.834mg/kg;其它种类食品的丙烯酰胺含量基本在0.1mg/kg以下,结果见表1。
由中国疾病预防控制中心营养与食品安全研究所提供的资料显示,在监测的100余份样品中,丙烯酰胺含量为:薯类油炸食品,平均含量为0.78mg/kg,最高含量为3.21mg/kg;谷物类油炸食品平均含量为0.15mg/kg,最高含量为0.66mg/kg;谷物类烘烤食品平均含量为0.13mg/kg,最高含量为0.59mg/kg;其它食品,如速溶咖啡为0.36mg/kg、大麦茶为0.51mg/kg、玉米茶为0.27mg/kg。就这些少数样品的结果来看,中国的食品中的丙烯酰胺含量与其他国家的相近。
食品中含量
表1:不同食品中丙烯酰胺的含量(24个国家的数据)
食品种类 |
样品数 |
均值 (µg/kg) |
最大值 (µg/kg) |
谷类 |
3,304 (12,346) |
343 |
7,834 |
水产 |
52 (107) |
25 |
233 |
肉类 |
138 (325) |
19 |
313 |
乳类 |
62 (147) |
5.8 |
36 |
坚果类 |
81 (203) |
84 |
1,925 |
豆类 |
44 (93) |
51 |
320 |
根茎类 |
2,068 (10,077) |
477 |
5,312 |
煮土豆 |
33 (66) |
16 |
69 |
烤土豆 |
22 (99) |
169 |
1,270 |
炸土豆片 |
874 (3,555) |
752 |
4,080 |
炸土豆条 |
1,097 (6,309) |
334 |
5,312 |
冻土豆片 |
42 (48) |
110 |
750 |
糖、蜜 (巧克力为主) |
58 (133) |
24 |
112 |
蔬菜 |
84 (193) |
17 |
202 |
煮、罐头 |
45 (146) |
4.2 |
25 |
烤、炒 |
39 (47) |
59 |
202 |
咖啡、茶 |
469 (1,455) |
509 |
7,300 |
咖啡 (煮) |
93 (101) |
13 |
116 |
咖啡 (烤, 磨, 未煮) |
205 (709) |
288 |
1,291 |
咖啡提取物 |
20 (119) |
1,100 |
4,948 |
咖啡,去咖啡因 |
26 (34) |
668 |
5,399 |
可可制品 |
23 (23) |
220 |
909 |
绿茶 (烤) |
29 (101) |
306 |
660 |
酒精饮料(啤酒,红酒,杜松子酒) |
66(99) |
6.6 |
46 |
可能摄入量
根据对世界上17个国家丙烯酰胺摄入量的评估结果显示,一般人群平均摄入量为0.3-2.0μg/kg bw/天,90-97.5百分位数的高消费人群其摄入量为0.6-3.5μg/kg bw/天,99百分位数的高消费人群其摄入量为5.1μg/kg bw/天。按体重计,儿童丙烯酰胺的摄入量为成人的2-3倍。其中丙烯酰胺主要来源的食品为炸土豆条16-30%,炸土豆片6-46%,咖啡13-39%,饼干10-20%,面包10-30%,其余均小于10%。JECFA根据各国的摄入量,认为人类的平均摄入量大致为1μg/kg bw/天,而高消费者大致为4μg/kg bw/天,包括儿童。由于中国尚缺少足够数量的各类食品中丙烯酰胺含量数据,以及这些食品的摄入量数据;因此,还不能确定中国人群的暴露水平。但由于食品中以油炸薯类食品、咖啡食品和烘烤谷类食品中的丙烯酰胺含量较高,而这些食品在中国人群中的摄入水平应该不高于其他国家,因此,中国人群丙烯酰胺的摄入水平应不高于JECFA评估的一般人群的摄入水平。
相关研究
研究证明“丙烯酰胺”广泛存在于许多加工食品中。它不是食品中的添加剂和配料,而是每当富含碳水化合物的食品以高温烹调或加热时,便以副产物的形式自然形成的。英国食品标准局(Food Standards Agency)报道了“丙烯酰胺”(Acrylamide)有关的可能风险,报道中涉及的日常食品包括薯条、咖啡及谷类食物等。“丙烯酰胺”从人类开始烹调或加热食品时就已经存在了,但科学界和医学界只是在十几年才注意到该化合物存在于富含碳水化合物的加工食品和家庭烘制、油炸或烤制的食品中,但到现在为止,尚没有科学研究对“丙烯酰胺”的危害有定论。世界卫生组织和许多著名食品安全专家建议,消费者更应食用由多种食物构成的平衡和健康的膳食,以降低丙烯酰胺的日常摄入量。
制备方法
食品种类 |
样品数 |
均值 (µg/kg) |
最大值 (µg/kg) |
谷类 |
3,304 (12,346) |
343 |
7,834 |
水产 |
52 (107) |
25 |
233 |
肉类 |
138 (325) |
19 |
313 |
乳类 |
62 (147) |
5.8 |
36 |
坚果类 |
81 (203) |
84 |
1,925 |
豆类 |
44 (93) |
51 |
320 |
根茎类 |
2,068 (10,077) |
477 |
5,312 |
煮土豆 |
33 (66) |
16 |
69 |
烤土豆 |
22 (99) |
169 |
1,270 |
炸土豆片 |
874 (3,555) |
752 |
4,080 |
炸土豆条 |
1,097 (6,309) |
334 |
5,312 |
冻土豆片 |
42 (48) |
110 |
750 |
糖、蜜 (巧克力为主) |
58 (133) |
24 |
112 |
蔬菜 |
84 (193) |
17 |
202 |
煮、罐头 |
45 (146) |
4.2 |
25 |
烤、炒 |
39 (47) |
59 |
202 |
咖啡、茶 |
469 (1,455) |
509 |
7,300 |
咖啡 (煮) |
93 (101) |
13 |
116 |
咖啡 (烤, 磨, 未煮) |
205 (709) |
288 |
1,291 |
咖啡提取物 |
20 (119) |
1,100 |
4,948 |
咖啡,去咖啡因 |
26 (34) |
668 |
5,399 |
可可制品 |
23 (23) |
220 |
909 |
绿茶 (烤) |
29 (101) |
306 |
660 |
酒精饮料(啤酒,红酒,杜松子酒) |
66(99) |
6.6 |
46 |
应用领域
合成简史
19世纪末,从丙烯酰氯与氨首次合成了丙烯酰胺。1954年,美国氰氨公司采用丙烯腈硫酸水解工艺进行工业生产。1972年,日本三井东压化学公司首先建立了骨架铜(见金属催化剂)催化丙烯腈水合制丙烯酰胺的工业装置,此后各国相继开发了不同类型的催化剂,采用此项工艺进行工业生产。80年代,日本日东化学工业公司实现了用生物催化剂由丙烯腈制丙烯酰胺的工业生产。
硫酸水合法
丙烯腈和水在硫酸存在下水解成丙烯酰胺的硫酸盐,然后用液氨中和生成丙烯酰胺和硫酸铵:
CH2=CHCN+H2O+H2SO4
─→CH2=CHCONH2·H2SO4
CH2=CHCONH2·H2SO4+2NH3
─→CH2=CHCONH2+(NH4)2SO4
此法的缺点是副产大量价值低廉、肥效不高的硫酸铵,又存在严重的硫酸腐蚀和污染等问题。
催化水合法
丙烯腈与水在铜系催化剂的作用下,于70~120℃、0.4MPa压力下进行液相水合反应。
CH2=CH-CN+H2O─→CH2=CHCONH2反应后滤去催化剂,回收未反应的丙烯腈,丙烯酰胺水溶液经浓缩、冷却得丙烯酰胺结晶。该法工艺流程简单,丙烯酰胺的选择性和收率可高达98%以上。
生化法
 丙烯酰胺生物法制取丙烯酰胺。系将丙烯腈、原料水和固定化生物催化剂调配成水合溶液.催化反应后分离出废催化剂就可得到丙烯酰胺产品 其特点是:在常温常压下反应.设备简单,操作安全;酶的特异性能使选择性极高.无副反应。采用J-1菌种时.反应温度为5~15℃,pH为7~8,反应区丙烯腈质量分数为1% 2%,丙烯腈转化率为99.99%,丙烯酰胺选择性为99.98%.反应器出口丙烯酰胺质量分数接近50%:失活的酶催化剂排出系统外的量小于产品的0.1% :无需离子交换处理,使分离精制操作大为简化:产品浓度高.无需提浓操作:整个过程操作简便,利于小规模生产。
丙烯酰胺生物法制取丙烯酰胺。系将丙烯腈、原料水和固定化生物催化剂调配成水合溶液.催化反应后分离出废催化剂就可得到丙烯酰胺产品 其特点是:在常温常压下反应.设备简单,操作安全;酶的特异性能使选择性极高.无副反应。采用J-1菌种时.反应温度为5~15℃,pH为7~8,反应区丙烯腈质量分数为1% 2%,丙烯腈转化率为99.99%,丙烯酰胺选择性为99.98%.反应器出口丙烯酰胺质量分数接近50%:失活的酶催化剂排出系统外的量小于产品的0.1% :无需离子交换处理,使分离精制操作大为简化:产品浓度高.无需提浓操作:整个过程操作简便,利于小规模生产。
生化法技术最早由日本日东化学公司于1985年实现工业化生产。规模为4 000 t/a 1991年已达1.4万t/a规模。
微生物法丙烯酰胺开创了国内生物法生产大宗化工产品、材料的先河,突破了国内高相对分子质量、超高相对分子质量聚丙烯酰胺的生产技术,并拓宽了其应用领域。从产品纯度上看,化学法丙烯酰胺中含有微量铜离子和其他金属离子.反应活性受到一定的影响 而微生物法丙烯酰胺则不存在这个问题.反应活性非常高.而反应活性决定了用丙烯酰胺做衍生物的反应速度和产率由于产品纯度高.因而聚合度高.特别适合于生产“三次采油”用聚丙烯酰胺。另外.从成本上看。仅原料消耗一项。微生物法就具有很大优势.丙烯腈单耗为0.76 t/t。而化学法为0.82t/t。特别是万吨级以上规模,其成本优势更加明显。可以说,微生物法从根本上“打倒” 了化学法从长远来看.微生物法肯定会取代化学法.这只是时间的问题。
水解法[5]
水解法制得的丙烯酰胺,其丙烯酸盐链节在大分子链上的分布是无规则的,它占大分子链上所有链节数的摩尔百分比即为水解度。共聚法相比,一般水解法制备的产物水溶性去屑因子(HD)不高,低于30%,理论上HD大于70%的产物应通过共聚法制取,该法对水解温度和事件有一定要求,同时水解过程中易发生大分子降解。
水溶液聚合反应
水溶液聚合反应时把反应单体及引发剂溶解在水中进行的聚合反应。该作法简单、环境污染少且聚合物产率高,易获得高相对分子质量聚合物,是聚丙烯酰胺工业生产最早采用的方法,而且一直是聚丙烯酰胺工业生产的主要方法。对水溶液聚合研究已经比较深入。
反相乳液聚合
反相乳液聚合及反相悬浮聚合之前都需要制备反相胶体分散体系,单体水溶液借助搅拌分散或乳化剂的油相中,形成水/油(W/0)非均相分散体系,然后加入引发剂进行游离基聚合。一般反相乳液聚合使用油溶性引发剂,多为阴离子型自由基引发剂和非离子自由基引发剂,而反相悬浮聚合多使用费水溶性引发剂,如过硫酸盐等。 有关AM/AA反相乳液聚合机理的成核机理存在两种看法:胶束成核及单体液滴成核。其动力学与典型正乳液聚合动力学有较大差别。
反相悬浮聚合
反相悬浮聚合时近10年发展起来的实现水溶性聚合物工业化生产的理想方法,1982年Di-monie利用电导、NMR、电镜研究了AM反相悬浮聚合。
其他聚合方法
除了上述方法外还可以通过Mannich反应、接枝共聚合复合作用等手段对丙烯酰胺及其衍生物的均聚物、共聚物进行改性。Mannich反应时在聚丙烯酰胺上引入胺类物质,是聚丙烯酰胺获得阳离子聚电接枝的重要途径,常用的胺有二甲胺、二乙胺、二乙醇胺等。AM/AA常与淀粉接枝共聚来制备高吸水树脂,或与其他大分子单体共聚从而将AM/AA接枝在某类膜。高相对分子质量阳离子聚丙烯酰胺(CPAM)广泛用于石油开采,但HPAM耐盐性较差。为了提高阳离子聚丙烯酰胺(CPAM)耐盐性,尚振平等人合成了端阳离子聚丙烯酰胺(CPAM)大分子单体,并在水溶液中中用硫酸亚铁/异丙苯过氧化氢氧化-还原体系引发丙烯酰胺、丙烯酸钠与聚(β-氨基丙酸)大分子单体的共聚反应,合成了(丙烯酰胺-CO-丙酸钠)-g-(β-氨基丙酸)接枝共聚物。
毒理危害
丙烯酰胺为丙烯酰胺系中最重要及最简单的一种,用途十分广泛,用作有机合成的原料及高分子材料的原料。其聚合物可溶于水,因而被用来生产水处理时的絮凝剂,尤其对水中的蛋白质、淀粉的絮凝有良好的效果。除有絮凝性外,还有增稠性、耐剪切性、降阻性、分散性等优良性能。用作土壤改良剂时,可增加土壤的水渗透性和保湿性;用作纸张填料辅剂,可增加纸张强度,以代替淀粉、水溶性氨树脂;用作化学灌浆剂,用于土木工程的隧道开掘、油井钻探、矿井和水坝等工程的堵漏;用作纤维改性剂,可改善合成纤维的物性;用作防腐剂,可用于地下构件的防腐;还可用于食品工业的添加剂、颜料的分散剂、印染糊剂。用于水的净化处理、纸浆的加工及管道的内涂层等,也用于聚丙烯酰胺凝胶电泳。用于酸相对分子质量的测定。用于油田注水井调整吸水剖面,将本品与引发剂等混合注入注水井高渗透层带,聚合成高粘度的聚合物。与酚醛树脂溶液配合,可制成玻璃纤维的粘合剂,与橡胶一起可制成压敏性粘合胶等。与乙酸乙烯、苯乙烯、氯乙烯、丙烯腈等单体聚合,可制备许多合成材料。本品还可用作医药、农药、染料、涂料的原料。
毒理资料
环境危害
R22Harmful if swallowed.
吞食有害。
R43 May cause sensitization by skin contact.
与皮肤接触可能致敏。
R45May cause cancer.
可能致癌。
R46May cause heritable genetic damage.
可能引起遗传性基因损害。
健康危害
依据丙烯酰胺的结构采用结构预测方法估计其不易被土壤吸附,在土壤中具有高度迁移性,易从土壤中浸出污染地下水,沙壤土中迁移性高于粘土。
相应地,进入水体的丙烯酰胺不易被吸附于悬浮颗粒物或沉积物。丙烯酰胺的亨利常数很低,其从水体表面和潮湿土壤挥发的可能性较小。鉴于其低蒸气压,丙烯酰胺也很难从干燥土壤中挥发。丙烯酰胺会以蒸气态或颗粒态进入大气,但气态丙烯酰胺进入大气后易被吸附于颗粒物上,只有极少的丙烯酰胺会以气态形式存在于空气中。空气中颗粒态的丙烯酰胺可通过沉降过程或雨水冲刷进入土壤和水环境,而土壤中的丙烯酰胺又易于渗滤入水环境,因此绝大部分进入环境的丙烯酰胺最终将进入水体。
生物降解是丙烯酰胺土壤降解的主要途径,主要机制之一是酶催化水解。土壤有氧条件下,丙烯酰胺经微生物作用可水解产生铵离子,铵离子经硝化作用被氧化为亚硝酸根离子和硝酸根离子。有氧土壤中,丙烯酰胺经14天可被降解74%~94%;而浸水的缺氧土壤中丙烯酰胺经14天可被降解64%~89%,可见有氧条件更有利于丙烯酰胺生物降解。依据土壤不同类型及理化性质,估计土壤中丙烯酰胺半衰期在21~36h。
水体消除丙烯酰胺的主要途径也是生物降解,水中可以分离出多种利用丙烯酰胺作为唯一碳源或氮源的微生物,如节杆菌、诺卡氏菌、球形芽孢杆菌、假单胞杆菌和红球菌。高的微生物活性尤其是表面微生物活性可以促进丙烯酰胺降解。
大气中气态的丙烯酰胺通过与光化学作用产生的羟基自由基(·OH)反应降解,羟基自由基浓度为5×105个·OH每立方厘米时该反应的半衰期为1.4天,还可与臭氧反应,臭氧浓度为7×1011个O3每立方厘米时,半衰期为6.5天 。丙烯酰胺对直接光解作用并不敏感,因为其不吸收波长>290nm的太阳光。
由于丙烯酰胺在水中具有高可溶性且半衰期较短,具有生物富集性的可能性较小。有学者对幼鳟72h静态实验研究表明,其身体和内脏对丙烯酰胺的生物浓缩因子(BCF)分别为0.86和1.12,整体BCF为1,丙烯酰胺没有明显的生物富集性。[6]
防治手段
研究表明,人体可通过消化道、呼吸道、皮肤黏膜等多种途径接触丙烯酰胺,饮水是其中的一条重要接触途径。2002年4月瑞典国家食品管理局和斯德哥尔摩大学研究人员率先报道,在一些油炸和烧烤的淀粉类食品,如炸薯条、炸土豆片等中检出丙烯酰胺,而且含量超过饮水中允许最大限量的500多倍。之后挪威、英国、瑞士和美国等国家也相继报道了类似结果。此外,人体还可能通过吸烟等途径接触丙烯酰胺。
丙烯酰胺进入体内又可通过多种途径被人体吸收,其中经消化道吸收最快。进入人体内的丙烯酰胺约90%被代谢,仅少量以原形经尿液排出。丙烯酰胺进入体内后,会在体内与DNA上的鸟嘌呤结合形成加合物,导致基因突变等遗传物质损伤。
对接触丙烯酰胺的职业人群和偶然暴露于丙烯酰胺人群的调查表明,丙烯酰胺具有神经毒性作用,但还没有充足的证据表明通过食物摄入丙烯酰胺与人类某种肿瘤的发生有明显关系。
根据香港消费者委员会的研究,含碳水化合物的食物在经油炸之后,都会产生丙烯酰胺。研究已知丙烯酰胺可致癌。但世界卫生组织表示,由于难以统计丙烯酰胺要到哪一个浓度才会致癌,所以难以订立安全标准。
急性毒性
急性毒性试验结果表明,大鼠、小鼠、豚鼠和兔的丙烯酰胺经口LD50为150-180 mg/kg,属中等毒性物质。
神经毒性
许多研究表明丙烯酰胺具有显著的神经毒性, 在人类的职业暴露以及动物实验中均有明确证据: 中国自20世纪70年代开始报道AM的中毒病例,尤其在职业暴露上屡见不鲜。研究发现AM中毒者主要的症状体征为皮肤脱皮红斑、四肢麻木、手足多汗、体重减轻及远端触痛觉减退、深反射减退等神经功能受损的症状;而猫、大鼠、小鼠、豚鼠、兔和猴等实验动物暴露AM后则会表现出共济失调、后肢足呈八字、骨骼肌无力,并最终导致运动障碍。近年研究表明,AM诱导神经毒性的可能机制如下:
氧化损伤与神经细胞凋亡调控
研究表明,活性氧族(reactive oxygen species,ROS)对细胞膜脂质、蛋白质和DNA不断攻击并造成相应靶分子累积氧化变性或损伤,是造成细胞代谢紊乱和功能异常的重要生理基础。当体内自由基和活性氧的产生与消除间不平衡时会产生氧化应激,从而引发许多疾病。中枢神经系统(central nervous system,CNS)是机体氧代谢较活跃的部位,其抗氧化酶活性低于其他组织,这使之易成为氧化损伤的主要靶器官。AM可能会通过诱导和影响氧化应激来引起神经损伤。同时,AM刺激也会激活细胞中的免疫通路并对产生的氧化应激进行防御。
另外,共轭α-β不饱和羰基衍生物,如丙烯醛(acrolein)和4-羟基-2-壬烯醛(4-hydroxy-2-nonenal)等一类属于II型烯烃,研究表明这种II型烯烃可能与内源性产生的不饱和醛协同作用,从而加大细胞损伤,加速了在涉及氧化应激的急性神经损伤(如脊髓创伤)和某些慢性神经疾病如阿尔兹海默症(Alzheimer disease,AD)、帕金森综合征(Parkinson’s syndrome,PD)等的过程。而AM在结构上也属于共轭α-β不饱和羰基衍生物。氧化应激可能是AM造成神经毒性,从而引发神经性疾病的一个主要机制。
血脑屏障功能损害
血脑脊液屏障(blood-cerebrospinal fluid barrier)主要由脉络丛(choroidplexus)上皮细胞之间的紧密连接构成,负责血液和脑脊液之间的物质转运。完整的血脑脊液屏障是保证中枢神经系统内环境稳定的重要条件。有学者发现鼠腹腔注射AM后脑脊液中甲状腺水平下降,瘦素(leptin,LP)转运水平被抑制,LP水平降低。由于瘦素具有促进大脑生长发育,降低促凋亡因子水平的作用,因此AM诱导的神经细胞凋亡也有可能是因血脑屏障中 LP水平的降低引起的。另外,AM还会造成紧密连接相关蛋白(zonula occludens-1,ZO-1)表达减少,屏障通透性增加,从而容易引起血清蛋白或其它神经毒物即可进入脑组织中,使神经系统的代谢及功能发生紊乱。
能量代谢障碍
有学者采用酶分析法发现AM染毒后大鼠脑组织匀浆中ATP合成酶活力下降,ATP水平明显降低,ADP和AMP增加,肌酸激酶(Creatine Kinase,CK)活力明显受到抑制,由于CK是轴突运输上的一个重要组成,因此推测能量代谢障碍可能是AM产生神经元损伤、神经病变的生化基础。
神经递质的改变与抑制
AM也可能通过改变神经递质水平和功能导致神经毒性,如阻碍神经末梢的膜融合过程。N-乙基顺丁烯二酰亚胺敏感性的融合蛋白(N-ethylmaleimide sensitive factor,NSF)是参与神经递质释放的一种ATP酶。
研究表明NSF可能是A的靶位点,在神经递质传递过程中AM与NSF蛋白264位甲硫氨酸位点(NSF Cys264)形成加合物来抑制突触小体对神经递质的释放,阻碍神经末梢膜融合,最终导致神经末梢变性;同时,AM还会导致纹状体多巴胺的含量显著降低,突触囊泡对多巴胺的摄取能力减弱,导致神经递质的存储障碍,进而也会引发递质的释放障碍。
在所抑制神经递质中,有研究指出:AM会导致大鼠大脑皮层和小脑内兴奋性神经递质谷氨酸(glutamic acid,Glu)降低,而抑制性神经递质γ-氨基丁酸(γ-aminobutyric acid,GABA)未发生变化。Glu是脑区最重要且常见的兴奋性神经递质,在学习记忆、躯体协调运动等方面发挥重要作用,因此大脑皮层和小脑兴奋性神经递质如Glu的降低可能是AM诱导神经毒性的机制之一。
生殖发育毒性
大量的动物试验研究表明丙烯酰胺主要引起神经毒性;此外,为生殖、发育毒性。神经毒性作用主要为周围神经退行性变化和脑中涉及学习、记忆和其他认知功能部位的退行性变;生殖毒性作用表现为雄性大鼠精子数目和活力下降及形态改变和生育能力下降。大鼠90天喂养试验,以神经系统形态改变为终点,最大未观察到有害作用的剂量(NOAEL)为0.2 mg/kg bw/天。大鼠生殖和发育毒性试验的NOAEL为2 mg/kg bw/天。
遗传毒性
许多研究表明AM进入机体后会影响动物的生育能力。研究发现对雄性成年大鼠和新生大鼠进行高剂量AM处理,会导致大鼠生长迟缓,进食量和生殖器官指数降低,附睾中精子数目减少并发生形态异常,同时睾丸组织也发生病变。
AM诱导的生殖毒性机制一方面是由于影响生殖器官中氧化应激状态,如影响可以清除组织中ROS的重要抗氧化酶,导致体内积累过多的ROS,损害细胞功能。同时,AM结合蛋白生成的加合物也会抑制细胞增殖。
另外,AM还会引起生殖细胞的基因损害。有学者发现长期暴露于低剂量AM,虽没有显著影响睾丸的质量和形态,但会造成雄性小鼠早期生殖细胞DNA损伤且具有剂量依赖性,然而这种基因性的损害可能会传递到下一代而引起遗传毒性。
免疫毒性
丙烯酰胺也会损伤胸腺和脾脏等免疫器官,从而抑制细胞免疫功能。研究发现在雌性Blb/c小鼠中AM会导致大鼠的体重、脾脏、胸腺及肠系膜淋巴结质量显著下降,淋巴细胞数减少,脾细胞增殖受到抑制,且淋巴结、胸腺、脾脏等组织病理学也发生改变。有学者在美国人群中观察到AM和GA会诱导如哮喘、发烧、打喷嚏、哮喘和湿疹等过敏类似反应,猜测这也可能与AM导致的免疫缺陷相关。AM造成免疫毒性可能是因为其破坏了T细胞膜表面的细胞因子——白细胞介素2(interleukin-2,IL-2)受体,使得IL-2活性降低,从而影响免疫应答过程细胞因子之间的相互作用,使免疫系统的调节受到破坏,因此导致机体出现免疫功能障碍。
致癌性
动物试验研究发现,丙烯酰胺可致大鼠多种器官肿瘤,包括乳腺、甲状腺、睾丸、肾上腺、中枢神经、口腔、子宫、脑下垂体等。国际癌症研究机构(IARC)1994年对其致癌性进行了评价,把丙烯酰胺列为2类致癌物(2A)即人类可能致癌物,其主要依据为丙烯酰胺在动物和人体均可代谢转化为其致癌活性代谢产物环氧丙酰胺。
其他毒性
丙烯酰胺还会对肝、肾、肺、膀胱、消化道等造成损害,主要表现在能显著抑制组织中抗氧化物酶SOD、GSH和GST的水平,增加脂质代谢产物MDA积累,造成组织损伤等。尤其肝脏作为线粒体和抗氧化物酶富集地,AM代谢的主要场所,其受氧化损伤、形态损伤和功能损伤作用最为明显;此外,AM通过胃肠道屏障时会使小肠的吸收和消化功能降低,肌体消瘦。也有研究表明消瘦的症状可能与AM和体内的肠道微生物作用有关。
实际资料
对接触丙烯酰胺的职业人群和因事故偶然暴露于丙烯酰胺的人群的流行病学调查,均表明丙烯酰胺具有神经毒性作用,但还没有充足的人群流行病学证据表明通过食物摄入丙烯酰胺与人类某种肿瘤的发生有明显相关性。
危险评估
由于煎炸食品是中国居民主要的食物,为减少丙烯酰胺对健康的危害,中国应加强膳食中丙烯酰胺的监测与控制,开展中国人群丙烯酰胺的暴露评估,并研究减少加工食品中丙烯酰胺形成的可能方法。对于广大消费者,专家建议:
1、尽量避免过度烹饪食品(如温度过高或加热时间太长),但应保证做熟,以确保杀灭食品中的微生物,避免导致食源性疾病。
2、提倡平衡膳食,减少油炸和高脂肪食品的摄入,多吃水果和蔬菜。
3、建议食品生产加工企业,改进食品加工工艺和条件,研究减少食品中丙烯酰胺的可能途径,探讨优化中国工业生产、家庭食品制作中食品配料、加工烹饪条件,探索降低乃至可能消除食品中丙烯酰胺的方法。
安全术语
概述
2002年4月瑞典国家食品管理局(National Food Administration,NFA)和斯德哥尔摩大学研究人员率先报道,在一些油炸和烧烤的淀粉类食品,如炸薯条、炸土豆片、谷物、面包等中检出丙烯酰胺;之后挪威、英国、瑞士和美国等国家也相继报道了类似结果。由于丙烯酰胺具有潜在的神经毒性、遗传毒性和致癌性,因此食品中丙烯酰胺的污染引起了国际社会和各国政府的高度关注。为此,2002年6月25日世界卫生组织(WHO)和联合国粮农组织(FAO)联合紧急召开了食品中丙烯酰胺污染专家咨询会议,对食品中丙烯酰胺的食用安全性进行了探讨。2005年2月,联合国粮农组织(FAO)和世界卫生组织(WHO)联合食品添加剂专家委员会(JECFA)第64次会议根据近两年来的新资料,对食品中的丙烯酰胺进行了系统的危险性评估。
接触途径
 油炸食物容易产生丙烯酰胺人体可通过消化道、呼吸道、皮肤粘膜等多种途径接触丙烯酰胺,饮水是其中的一种重要接触途径,为此WHO将水中丙烯酰胺的含量限定为1μg/L。2002年4月斯德哥尔摩大学研究报道,炸薯条中丙烯酰胺含量较WHO推荐的饮水中允许的最大限量要高出500多倍。因此,认为食物为人类丙烯酰胺的主要来源。此外,人体还可能通过吸烟等途径接触丙烯酰胺。
油炸食物容易产生丙烯酰胺人体可通过消化道、呼吸道、皮肤粘膜等多种途径接触丙烯酰胺,饮水是其中的一种重要接触途径,为此WHO将水中丙烯酰胺的含量限定为1μg/L。2002年4月斯德哥尔摩大学研究报道,炸薯条中丙烯酰胺含量较WHO推荐的饮水中允许的最大限量要高出500多倍。因此,认为食物为人类丙烯酰胺的主要来源。此外,人体还可能通过吸烟等途径接触丙烯酰胺。
吸收代谢
丙烯酰胺可通过多种途径被人体吸收,其中经消化道吸收最快,在体内各组织广泛分布,包括母乳。经口给予大鼠0.1 mg/kg bw的丙烯酰胺,其绝对生物利用率为23-48%。进入人体内的丙烯酰胺约90%被代谢,仅少量以原型经尿液排出。丙烯酰胺进入体内后,在细胞色素P4502E1的作用下,生成活性环氧丙酰胺(glycidamide)。该环氧丙酰胺比丙烯酰胺更容易与DNA上的鸟嘌呤结合形成加合物,导致遗传物质损伤和基因突变;因此,被认为是丙烯酰胺的主要致癌活性代谢产物。研究报道,给予大小鼠丙烯酰胺后,在小鼠肝、肺、睾丸、白细胞、肾和大鼠肝、甲状腺、睾丸、乳腺、骨髓、白细胞和脑等组织中均检出了环氧丙酰胺鸟嘌呤加合物。尚未见人体丙烯酰胺暴露后形成DNA加合物的报道。
此外丙烯酰胺和环氧丙酰胺还可与血红蛋白形成加合物,在给予动物丙烯酰胺和摄入含有丙烯酰胺食品的人群体内均检出血红蛋白加合物,建议可用该血红蛋白加合物作为接触性生物标志物来推测人群丙烯酰胺的暴露水平。
危险评估
对非遗传毒性物质和非致癌物的危险性评估,通常方法是在NOAEL的基础上再加上安全系数,产生出每天容许摄入量(ADI)或每周耐受摄入量(PTWI),用人群实际摄入水平与ADI或PTWI进行比较,就可对该物质对人群的危险性进行评估。而对遗传毒性致癌物,以往的危险性评估认为应尽可能避免接触这类物质,没有考虑这类物质摄入量和致癌作用强度的关系,没有可接受的耐受阈剂量,因此管理者不能以此来确定监管污染物的重点和预防措施,而管理者又非常需要评估者提供不同摄入量可能造成的不同健康危险度的信息。因此,国际上在对该类物质进行危险性评估时,建议用剂量反应模型BMDL和暴露限(MOE)进行评估。BMDL为诱发5%或10%肿瘤发生率的低侧可信限,BMDL除以人群估计摄入量,则为暴露限(MOE)。MOE越小,该物质致癌危险性也就越大,反之就越小。
对丙烯酰胺的非致癌效应进行评估,动物试验结果引起神经病理性改变的NOAEL值为0.2 mg/kg bw。根据人类平均摄入量为1µg/kg bw/天,高消费者为4µg/kg bw/天进行计算,则人群平均摄入和高摄入的MOE分别为200和50;丙烯酰胺引起生殖毒性的NOAEL值2mg/kg bw,则人群平均摄入和高摄入的MOE分别为2000和500。JECFA认为按估计摄入量来考虑,此类副作用的危险性可以忽略,但是对于摄入量很高的人群,不排除能引起神经病理性改变的可能。
对丙烯酰胺的危险性评估重点为致癌效应的评估。由于流行病学资料及动物和人的生物学标记物数据均不足以进行评价,因此根据动物致癌性试验结果,用8种数学模型对其致癌作用进行分析。最保守的估计,推算引起动物乳腺瘤的BMDL为0.3mg/kg bw/天,根据人类平均摄入量为1 µg/kg bw/天,高消费者为4 µg/kg bw/天计算,平均摄入和高摄入量人群的MOE分别为300和75。JECFA认为对于一个具有遗传毒性致癌物来说,其MOE值较低,也就是诱发动物的致癌剂量与人的可能最大摄入量之间的差距不够大,比较接近,其对人类健康的潜在危害应给予关注,建议采取合理的措施来降低食品中丙烯酰胺的含量。欧洲有些食品生产企业在减少食品加工过程中丙烯酰胺的产生方面已取得了很好的效果。
在对丙烯酰胺的危险性评估中,用动物实验来推导的BMDL数据,人群摄入量评估,加之人与动物代谢活化强度的差别,因此存在不确定性。故需在进行的几项丙烯酰胺的长期动物试验结束后再次进行评价,并需考虑丙烯酰胺在体内转化为环氧丙酰胺的情况,以及发展中国家丙烯酰胺摄入量的数据,并将人体生物学标记物与摄入量和毒性终点结果相联系进行评估。
2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,丙烯酰胺在2类致癌物清单中。
风险术语
S24:Avoid contact with skin.
避免皮肤接触。
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
眼睛接触后,立即用大量水冲洗并征求医生意见。
S36/37/39:Wear suitable protective clothing, gloves and eye/face protection.
穿戴适当的防护服、手套和眼睛/面保护。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the lable where possible).
发生事故时或感觉不适时,立即求医(可能时出示标签)。
S53:Avoid exposure - obtain special instructions before use.
避免接触,使用前获得特别指示说明。
词条图册
R43:May cause sensitization by skin contact.
皮肤接触可能引起过敏。
R45:May cause cancer.
可能致癌。
R46:May cause heritable genetic damage.
可能造成不可逆的遗传损害。
R48/20/21/22:Harmful : danger of serious damage to health by prolonged exposure through inh.,in contact with skin and if swallowed.
有害的:经吸入、皮肤和吞食长期接触有严重损害健康的危险。

-
丙烯酸丁酯压敏胶黏剂
2025-11-01 07:40:56 查看详情


 求购
求购







