- 酸碱质子理论

酸碱质子理论
概述
 酸碱质子理论当一个分子或离子释放氢离子,同时一定有另一个分子或离子接受氢离子,因此酸和碱会成对出现。酸碱质子理论可以用以下反应式说明: 酸 + 碱≒共轭碱 + 共轭酸 酸在失去一个氢离子后,变成共轭碱;而碱得到一个氢离子后,变成共轭酸。以上反应可能以正反应或逆反应的方式来进行,不过不论是正反应或逆反应,均维持以下的原则:酸将一个氢离子转移给碱。
酸碱质子理论当一个分子或离子释放氢离子,同时一定有另一个分子或离子接受氢离子,因此酸和碱会成对出现。酸碱质子理论可以用以下反应式说明: 酸 + 碱≒共轭碱 + 共轭酸 酸在失去一个氢离子后,变成共轭碱;而碱得到一个氢离子后,变成共轭酸。以上反应可能以正反应或逆反应的方式来进行,不过不论是正反应或逆反应,均维持以下的原则:酸将一个氢离子转移给碱。
在上式中,酸和其对应的共轭碱为一组共轭酸碱对。而碱和其对应的共轭酸也是一组共轭酸碱对。
酸碱概念
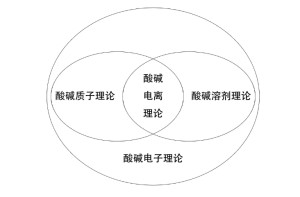
酸碱离子理论是阿累尼乌其斯(Arrhenius)根据他的电离学说提出来的。他认为在水中能电离出氢离子并且不产生其它阳离子的物质叫酸。在水中能电离出氢氧根离子并且不产生其它阴离子的物质叫碱。酸碱中和反应的实质是氢离子和氢氧根离子结合成水。这个理论取得了很大成功,但它的局限性也早就暴露出来,倒台。例如气态氨与氯化氢反应迅速生成氯化铵,这个酸碱中和反应并未掺杂水的生成;又如氨的水溶液显碱性,曾被错误地认为是NH3和H2O形成弱电解质NH4OH分子,然后离解出OH-等。 由于阿累尼乌斯的酸碱离子理论不能解一些非水溶液中进行的酸碱反应等问题,1923年布朗特(Bronsted)提出了酸碱质子理论,把酸碱概念加以推广。酸碱质子理论认为凡是能给出质子的物质都是酸,凡是能与质子结合的物质都是碱。即酸是质子的给予体,碱是质子的接受体。这样,一个酸给出质子后余下的部分自然就是碱,因为它本身就是与质子结合的。它们的关系如下: 这种关系叫做酸碱的共轭关系,式中略去了HB和B可能出现的电荷。右边的碱是左边酸的共轭碱,左边的酸是右边碱的共轭酸,两者组成一个共轭酸碱对,它们只差一个质子。
酸和碱可以是分子,也可以是阳离子和阴离子。还可以看出,像HPO2-4这样的物质,既表现酸,也表现为碱,所以它是两性物质。同理,H2O,HCO3-等也是两性物质。
共轭酸碱的强弱
用KW表示[H3O+][OH-],KW称为水的离子积。这说明在一定温度下,水中的[H3O+]与[OH-]的乘积为一常数。所以 Ka·Kb=KW
24℃时KW值为1.0×10-14.这个关系说明,只知道了酸的离解常数Ka,就可以计算出它的共轭碱的Kb,反之亦然。Ka和Kb是成反比的,而Ka和Kb正是反映酸和碱的强度,所以,在共轭酸碱对中,酸的强度愈大,其共轭碱的强度愈小;碱的强度愈大,其共轭酸的强度愈小。
一些共轭酸碱对的强度次序。
酸性增强 共轭酸(HB) Ka(在水中) pKa(在水中) 共轭碱(B) 碱性增强
H3O+ H2O H2C2O4 5.4×10-2 1.27 HC2O-4 H2SO3 1.54×10 1.81 HSO-3 HSO-4 1.20×10-2 1.92 SO2-4 H3PO4 7.51×10-3 2.12 H2PO-4 HNO2 4.6×10-4 3.37 NO-2 HF 3.53×10-4 3.45 F- HCOOH 1.77×10-4 3.75 HCOO- HC2O-4 5.4×10-5 4.27 C2O2-4 CH3COOH 1.76×10-5 4.75 CH3COO- H2CO3 4.30×10-7 6.37 HCO-3 HSO-3 1.02×10-7 6.91 SO2-3 H2S 9.1×10-8 7.04 HS- H2PO-4 6.23×10-8 7.21 HPO2-4 NH+4 5.68×10-10 9.25 NH3 HCN 4.93×10-10 9.31 CH- HCO-3 5.61×1011 10.25 CO2-3 H2O2 2.4×10-12 11.62 HO-2 HS- 1.1×10-12 11.96 S2- HPO2-4 2.2×10-13 12.67 PO3-4 H2O OH-
根据酸碱质子理论,酸碱在溶液中所表现出来的强度,不仅与酸碱的本性有关,也与溶剂的本性有关。我们所能测定的是酸碱在一定溶剂中表现出来的相对强度。同一种酸或碱,如果溶于不同的溶剂,它们所表现的相对强度就不同。例如HOAc在水中表现为弱酸,但在液氨中表现为强酸,这是因为液氨夺取质子的能力(即碱性)比水要强得多。这种现象进一步说明了酸碱强度的相对性。
酸碱反应
酸碱质子理论中的酸碱反应是酸碱之间的质子传递
这个反应无论在水溶液中、苯或气相中,它的实质都是一样的。HCL是酸,放出质子给NH3,然后转变成共轭碱CL-,NH3是碱,接受质子后转变成共轭酸NH4+。强碱夺取了强酸放出的质子,转化为较弱的共轭酸和共轭碱。
酸碱质子理论不仅扩大了酸碱的范围,还可以把酸碱离解作用、中和反应、水解反应等,都看作是质子传递的酸碱反应。
由此可见,酸碱质子理论更好地解释了酸碱反应,摆脱了酸碱必须在水中才能发生反应的局限性,解决了一些非水溶剂或气体间的酸碱反应,并把水溶液中进行的某些离子反应系统地归纳为质子传递的酸碱反应,加深了人们对酸碱和酸碱反应的认识。但是酸碱质子理论不能解释那些不交换质子而又具有酸碱性的物质,因此它还存在着一定的局限性。
质子酸碱理论
1923年丹麦化学家布朗斯特和英国化学家劳尔分别提出酸碱反应的实质是质子从一个物种向另一个物种的转移。任何可以给出质子的物质(分子或离子)就是酸,任何可以接受质子的物质(分子或离子)就是碱。酸和碱的关系可以表示为:
HA⇋A- + H+ 酸⇋碱+质子
满足上述关系的一对酸和碱称为共轭酸碱对。例如:
HCl⇋Cl- + H+ [Al(H2O)6]3+⇋[Al(H2O)5OH]2+ + H+
NH4+⇋NH3 + H+ HAc⇋Ac- + H+
H2PO4-⇋(HPO4)2- + H+ (HPO4)2-⇋(PO4)3- + H+
左边的反应物是酸,右边的产物有H+和碱。上式后两例表面,(HPO4)2-既是一种酸,也是一种碱,这类分子活离子称为两性物质。
水—离子论把溶剂局限于水,而质子论不受水的限制,它强调的是有质子参加反应的物质,因此质子论的酸碱范围就广泛得多。水—离子理论把物质分为酸、碱和盐,而质子酸碱理论把物质分为酸、碱和非酸非碱物质。
质子论中的酸碱反应都可看作是质子在两种共轭酸碱对之间的传递。由前面举出的例子表示的酸碱平衡并不能单独进行,因为质子的离子半径小,有带正电荷,所以不可能以游离状态存在。事实上,质子在水溶液中的平均寿命约十的负十四次方秒。因此,质子一出现,便立即附着于另一种分子或离子,产生一种酸。显然,上述例子各反应只有当溶液中同时存在两种共轭酸碱对时才能进行。
酸碱质子理论所需解决的问题
:对于酸和碱,除了以前学习过的电离理论外,是否还有新的理论,它们有什么特点,如何应用?
一: 质子酸和碱的定义(C级重点掌握)
质子理论认为: 凡能给出质子(H+)的物质都是酸;凡能接受质子的物质都是碱。在质子理论中,酸和碱不局限于分子,还可以是阴,阳离子.若某物质既能给出质子又能接受质子,就既是酸又是碱,可称为酸碱两性物质。如HSO4-,NH3,HCO3-等。因此,在质子理论中没有盐的概念。
二: 共轭酸和碱(C级重点掌握)
根据酸碱质子理论,酸和碱不是孤立的.酸给出质子后生成碱,碱接受质子后变成酸,这种对应关系互称为共轭关系.
酸 质子 + 碱
右边的碱是左边酸的共轭碱;左边的酸又是右边碱的共轭酸.酸越强,它对应的共轭碱的碱性就越弱;反之,酸越弱,它对应的共轭碱就越强.
思考题:
9-1.1:共轭酸碱之间具有什么关系?SO42-是否是H2SO4的共轭碱(C级重点掌握)
三: 酸碱反应的实质(C级掌握)
根据酸碱质子理论,酸碱反应的实质,就是两个共轭酸碱对之间质子传递的反应.
1. 电离反应:
HCl |
+ |
H2O |
H3O+ |
+ |
Cl- |
|
酸1 |
|
碱2 |
|
酸2 |
|
碱1 |
2. 中和反应
HAc |
+ |
NH3 |
NH4+ |
+ |
Ac- |
|
酸1 |
|
碱2 |
|
酸2 |
|
碱1 |
3. 水解反应
H2O |
+ |
Ac- |
HAc |
+ |
OH- |
|
酸1 |
|
碱2 |
|
酸2 |
|
碱1 |
四: 酸碱质子理论的局限(C级了解)
酸碱质子理论扩大了电离理论中的酸碱的范围,又可在非水溶剂或气态下适用.但因其限制于质子放出和接受,对于不含氢的一类化合物是不能解释的.
练习:
9-1.1:指出下列物质哪些是酸,哪些是碱,哪些既是酸又是碱,并写出它们对应的共轭碱或酸的形式(C级重点掌握)
H2SO4;CO32-;HCO3-;H2O;NH3;NO2-;H2PO4-。
例1(C级重点掌握)
9-1* 酸碱电子理论(A级掌握)
一:电子酸碱的定义
美国物理学家路易斯提出的酸碱电子理论认为:凡是可以接受电子对的物质称为酸,凡是可以给出电子对的物质称为碱。因此,酸又是电子对的接受体,碱是电子对的给予体.而酸碱反应的实质是配位键的形成并生成酸碱配合物.
根据电子理论,凡金属离子都是酸,与金属离子结合的不管是阴离子或中性分子都是碱.而一切盐类,金属氧化物等大多数无机化合物都是酸碱配合物.
二:酸碱电子理论的不足
酸碱电子理论中的酸和碱又称为路易斯酸和碱.该理论对酸碱的定义较别的理论更为全面和广泛,但正因为如此,对酸碱的认识过于笼统,不易掌握酸碱的特性.
三:*软硬酸碱理论简介
1. 路易斯酸碱的分类
1963年,美国化学家皮尔逊(Pearson,R.G.)把路易斯酸碱分成软硬两大类,即硬酸,软酸,硬碱,软碱.
1) 硬酸(接受电子原子)的特征是体积小,正电荷高,极化性低,也就是对外层电子控制得紧.
2) 软酸(接受电子原子)的特征是体积大,正电荷低或等于零,极化性高,并往往具有易于激发的d电子,也就是对外层电子控制得松驰.
3) 硬碱(给电子原子)极化性低,电负性高,难氧化,对外层电子控制得紧,难失去.
4) 软碱(给电子原子)极化性高,电负性低,容易氧化,外层电子容易失去.
用“软”,“硬”二字表示酸碱对外层电子控制的程度,随其程度不同,有不同的硬度和软度.介于软硬酸碱之间的酸碱称为交界酸碱.下面是软硬酸碱的分类表.
软,硬和交界酸的分类表
酸 类 |
|
硬 酸 |
H+,Li+,Na+,K+,Rb+,Cs+ |
Be2+,Mg2+,Ca2+,Sr2+,Ba2+ |
|
Sc3+,La3+,Ce4+,Gd3+,Lu3+,Th4+,U4+,UO22+,Pu4+ |
|
Ti4+,Zr4+,Hf4+,VO2+,Cr3+,MoO3+,WO4+,Mn2+,Fe3+,Co3+ |
|
BF3,Al3+,Al(OH)3,AlCl3,Ga3+,Ln3+ |
|
CO2,Si4+,Sn4+, |
|
N3+,As3+ |
|
SO3,RSO2- |
|
Cl3+,Cl7+,I5+,I7+ |
|
HX(能形成氢键的分子) |
|
交 界 酸 |
Fe2+,Co2+,Ni2+,Cu2+,Zn2+ |
Rh3+,Ir3+,Ru3+,Os2+ |
|
B(OH)3,GaH3 |
|
R3C+,C6H5+,Sn2+,Pb2+ |
|
NO+,Sb3+,Bi3+ |
|
SO2 |
|
软 酸 |
Co(CN)53-,Pd2+,Pt2+,Pt4+ |
Cu+,Ag+,Au+,Cd2+,Hg+,Hg2+ |
|
BH3,Ga(CH3)3,GaCl3,GaBr3,GaI3,Ti+,Tl(CH3)3 |
|
CH2,碳烯类 |
|
π接受体:三硝基本,醌类 |
|
HO+,RO+,RS+,RSe+,Te4+,RTe+ |
|
Br2,Br+,I2,I+,ICN等 |
|
金属 |
软,硬和交界碱的分类表 |
碱类 |
|
硬 碱 |
NH3,RNH2,N2H4 |
H2O,OH-,O2-,ROH,RO-,R2O |
|
CH3COO-,CO32-,NO3-,PO43-,SO42-,ClO4- |
|
F-,(Cl-) |
|
交 界 碱 |
C6H5NH2,C6H5N,N3-,N2 |
NO2-,SO32- |
|
Br- |
|
软 碱 |
H+ |
R-,C2H4,C6H6,CN-,RNC,CO |
|
SCN-,R3P,(RO)3P,R3As |
|
R2S,RS-,S2O32- |
|
I- |
2. 软硬酸碱的结合原则
软硬酸碱原则的内容是:硬酸倾向于同硬碱结合,软酸则同软碱相结合.即“硬亲硬,软亲软,不软不硬就不管”.“倾向于”的意思是指硬-硬,软-软结合能形成稳定配合物,且反应速度较快.而硬-软结合的倾向较小,所形成的配合物不够稳定,且反应速度较慢.交界酸碱不论对象是硬还是软,均能与之反应,所形成的配合物的稳定性及反应速度适中.这是大量事实的总结,是经验性原则.它能够对无机化学中许多繁杂的现象进行一定说明或归纳.例如一些金属矿物存在的形式,汞,银,铅等过渡元素的离子都是软酸,S2-是软碱,所以它们的矿物一般是硫化物.而ⅠA,ⅡA等主族元素以及某些过渡元素的离子为硬酸.它们的矿物一般是氧化物,氟化物,碳酸盐和硫酸盐,因为O2-,F-,CO32-,SO42-均为硬碱.
词条图册
HCl |
+ |
H2O |
H3O+ |
+ |
Cl- |
|
酸1 |
|
碱2 |
|
酸2 |
|
碱1 |

-
柯明斯基理论 第三季
2025-11-03 18:25:31 查看详情


 求购
求购









