- 双水解
双水解
基础定义
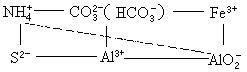 双水解如:泡沫灭火器中的主要化学物质是碳酸氢钠与硫化铝,互相促进水解生成二氧化碳气体和氢氧化铝沉淀,从而产生大量的泡沫。
双水解如:泡沫灭火器中的主要化学物质是碳酸氢钠与硫化铝,互相促进水解生成二氧化碳气体和氢氧化铝沉淀,从而产生大量的泡沫。
Al(HCO3)3=Al(OH)3↓+3CO2↑
Al2S3+6H2O=2Al(OH)3↓+3H2S↑
AlN+3H2O=Al(OH)3↓+NH3↑
弱酸阴离子与弱碱阳离子在水溶液中互相促进水解,水解程度增大。水解问题包含彻底水解和不彻底水解。有些互促水解反应不能完全进行,有些互促水解反应能完全进行(俗称“双水解反应”)。常见的双水解进行完全的有:![]() 、
、![]() 与
与![]() 、
、![]() (
(![]() )。
)。
应用举例
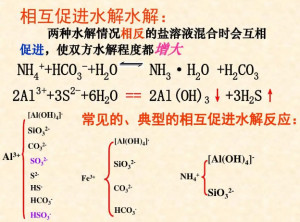 双水解(3)发生双水解的离子不共存。
双水解(3)发生双水解的离子不共存。
下面我们思考这样一个问题:Al3+遇到比碳酸还弱的酸的酸根如:ClO-、SiO32-、AlO2-等会不会发生“双水解反应”呢?根据以上条件,答案是肯定的。
完全水解的意思:
当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水而使两种离子的水解平衡向水解方向移动而互相促进水解,而水解完全。
发生条件
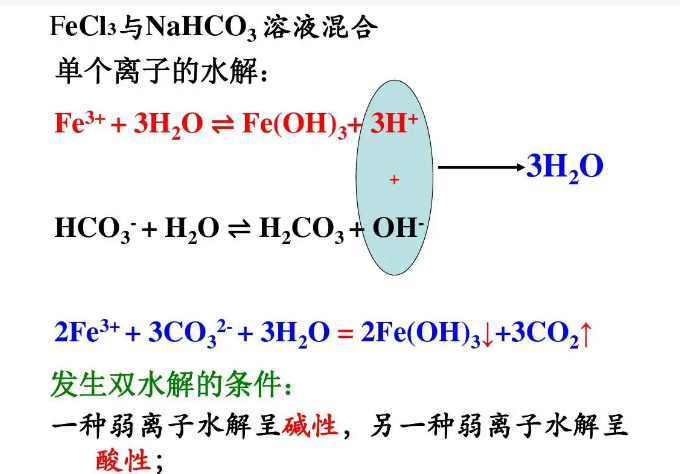 双水解(3)首先我们来分析Al3+与HCO3–在水溶液中为什么能发生“双水解反应”而Mg2+与CO32-或HCO3-却不能发生“双水解反应”?互相促进水解其水解程度增大,由于Al(OH)3溶解度非常小且H2CO3又不稳定易分解即生成的水解产物能脱离反应体系,根据平衡移动原理水解反应继续向右进行,直至反应完全进行;但Mg(OH)2溶解度比 Al(OH)3大些,不容易脱离反应体系,则水解反应进行到一定程度就达到平衡,水解反应不能完全进行。由上不难看出: 生成的水解产物脱离反应体系是反应得以完全进行的重要原因. 因此, “双水解反应”发生的条件之一是:水解产物是容易脱离反应体系(溶解度非常小)的物质如:Al(OH)3、Fe(OH)3或H2S、CO2等极难溶的气体。当然,若互相促进水解程度非常大水解反应也可以认为完全进行。
双水解(3)首先我们来分析Al3+与HCO3–在水溶液中为什么能发生“双水解反应”而Mg2+与CO32-或HCO3-却不能发生“双水解反应”?互相促进水解其水解程度增大,由于Al(OH)3溶解度非常小且H2CO3又不稳定易分解即生成的水解产物能脱离反应体系,根据平衡移动原理水解反应继续向右进行,直至反应完全进行;但Mg(OH)2溶解度比 Al(OH)3大些,不容易脱离反应体系,则水解反应进行到一定程度就达到平衡,水解反应不能完全进行。由上不难看出: 生成的水解产物脱离反应体系是反应得以完全进行的重要原因. 因此, “双水解反应”发生的条件之一是:水解产物是容易脱离反应体系(溶解度非常小)的物质如:Al(OH)3、Fe(OH)3或H2S、CO2等极难溶的气体。当然,若互相促进水解程度非常大水解反应也可以认为完全进行。
综上所述,双水解反应能否完全进行决定于两个因素:1.互相促进水解程度大小(包括物质本性、外界条件等的影响)2.水解产物的溶解度。
重要方程
双水解离子方程式用“═”连接,且标记“↑”和“↓”
中学化学中常见的能发生“水解相互促进的反应”的离子对有:(水溶液中,AlO2-以Al(OH)4-的形式存在)
Al3+与HCO3-、CO32-、HS-、S2-、ClO-、![]() 、SiO32-;
、SiO32-;
Fe3+与HCO3–、CO32–、ClO-、![]() 、SiO32-等;
、SiO32-等;
Fe2+与![]() ;
;
Mg2+与![]() 【
【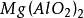 沉淀】;
沉淀】;
NH4+与SiO32-、![]() 、ClO-等。
、ClO-等。
实际上,由于Al(OH)3、Fe(OH)3溶解度非常小,比碳酸稍弱的酸的酸根与Fe3+、Al3+也能发生“双水解反应”。
1、【铝离子和碳酸氢根离子】
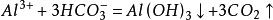
2、【铝离子和碳酸根离子】
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
3、【铝离子和硫离子】
2Al3++3S2-+6H20=2Al(OH)3↓+3H2S↑
4、【铝离子和HS-(硫氢根)离子】
Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑
5、【铁离子和四羟基合铝酸根离子】
Fe3++3(Al(OH)4)-=Fe(OH)3↓+3Al(OH)3↓
6、【铁离子和碳酸根离子】
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑
7、【铵根离子和四羟基合铝酸根离子】
NH4++(Al(OH)4)-=NH3·H2O+Al(OH)3↓
8、【铁离子和碳酸氢根离子】
Fe3++3HCO3-=Fe(OH)3↓+3CO2↑(因为反应物和生成物中都有水抵消,故不表示出来)
9、【铵根离子和偏铝酸根离子】
AlO2- + NH4+ + H2O == Al(OH)3↓+ NH3↑
10、【铝离子和偏铝酸根离子】
Al3+ + 3AlO2- + 6H2O ═ 4Al(OH)3↓
常见谣言
 双水解(3)谣言1:铝离子与碳酸氢根发生完全双水解,即Al3++3HCO3-=Al(OH)3↓+3CO2↑
双水解(3)谣言1:铝离子与碳酸氢根发生完全双水解,即Al3++3HCO3-=Al(OH)3↓+3CO2↑
驳斥:铝离子与碳酸氢根并不一定发生完全双水解,只要稍加控制反应条件,铝离子与碳酸氢根就可以发生反应形成碱式碳酸铝盐如碳酸铝铵,如以下实例:
对碳酸铝铵合成的工艺条件进行了研究,研究了反应物的滴定次序、溶液浓度及加入速度、反应温度等因素对反应产物的影响。实验结果表明,Al3+周围有足够的碳酸氢铵是生成碳酸铝铵的关键,必须将硫酸铝铵加入到碳酸氢铵溶液中,并且碳酸氢铵的浓度大于1.0mol/L才有可能生成碳酸铝铵。[2]
又如以下实例,碳酸根与铝离子并未发生完全双水解,而是形成碳酸铝铵:
以硝酸铝为原料,碳酸铵为沉淀剂,合成前驱体碳酸铝铵,然后煅烧得到纳米级氧化铝粉体。[3]
不仅如此,而且事实上国外最迟在二十世纪七十年代就已经将上述不完全双水解的产物碳酸铝钠作为化工产品打入市场[4]。
谣言2:醋酸铁双水解不存在,因为Fe3+的水解程度很高,醋酸的酸性不足以产生Fe3+的盐类
变体:醋酸铁在水中……,醋酸根水解消耗氢离子,铁离子水解消耗氢氧根,这样会导致双水解,即水中生成的是醋酸分子还有氢氧化铁沉淀。
驳斥:铁离子与醋酸根的双水解反应并不完全,以至于形成的碱式醋酸铁(而不是形成氢氧化铁)可以在水中比较稳定的存在,并且可以通过乙酸溶解氢氧化铁来进行制备。
碱式醋酸铁的性质:
红褐色叶片状结晶或无定形粉末,略带醋酸气味。冷水中缓慢溶解,热水中迅速溶解,溶于乙醇、醋酸。应避光保存。
附制法:
FeCl3+3NH3·H2O→Fe(OH)3+3NH4Cl
2Fe(OH)3→Fe2O3+3H2O
Fe2O3+4CH3COOH→2Fe(OH)(CH3COO)2+H2O
室温下,在稀三氯化铁溶液中加入氨水,生成氢氧化铁(Ⅲ)沉淀。采用倾泻法用冷水对沉淀进行多次洗涤,抽滤出沉淀,再用水充分洗涤,数日后,得到膏状水合氧化铁(Ⅲ),将其加热溶于大致等量的乙酸中。将所得溶液放在蒸发皿中,放在通风良好处数日,析出碱式醋酸铁结晶[5]。
谣言3:Ag+ 与 CO32- ,会发生双水解反应,生成CO2气体,和AgOH沉淀[6][7]
驳斥:硝酸银与碳酸钠并不发生双水解反应,而是发生正常的复分解反应形成碳酸银沉淀[8],不应被网络上的一些错误见解误导。下为碳酸银的制法:
将碳酸钠或碳酸氢钠加入到硝酸银溶液中。用碳酸钠为原料时,为了避免生成的碳酸银沉淀中含氧化物,所以应避免加入过量的沉淀剂。将沉淀过滤,用水洗涤后,在浓硫酸和五氧化二磷上干燥至恒重。因为纯的碳酸银对光十分敏感,所以应在红光下处理产品。
在搅拌下,将碳酸钠稀溶液缓慢加到硝酸银水溶液中 ( 使硝酸银稍过量) ,并继续搅拌至反应完全。然后过滤,滤出的碳酸银用少量水洗涤至合格,风干后即得成品。
书写流程
以氯化铝和硫化钠的双水解为例来详细阐述双水解方程式的书写过程
第一步:根据混和的两种电解质溶液找出弱碱的阳离子(Al3+)及对应的弱碱[Al(OH)3]( 如弱碱为氨水,由于其分解,常写成NH3形式);弱酸的阴离子(S2-)及对应的弱酸(H2S)(如弱酸易分解,则应写成分解产物形式,如H2CO3写成CO2)。然后写成下列形式:弱碱的阳离子(Al3+)+弱酸的阴离子(S2-)——弱碱[Al(OH)3] ↓(或其分解产物)+弱酸(H2S)↑(或其分解产物)
第二步:根据正负电荷守恒配平上式
2Al3++3S2-=2Al(OH)3↓+3H2S↑
第三步:根据质量守恒,用一定数目的水分子平衡方程式中的氢、氧原子,即可得离子方程式。
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
第四步:根据上述离子方程式及电离原理迅速得出化学方程式。因为Al3+由AlCl3提供,2个Al3+有2个AlCl3; S2-由Na2S提供,3个S2-有3个Na2S,然后由质量守恒得出产物中应有6NaCl。
2AlCl3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑+6NaCl

-
全新小鹏P7i将于3月10日上市 配置水平升级
2025-11-01 15:00:08 查看详情 -
零跑新车上市专访:不怕你不买 配置水平升级
2025-11-01 15:00:08 查看详情


 求购
求购



