- 氙

氙
研究简史
氙于1898年7月由拉姆齐(William Ramsay)和特拉维斯(Morris W.Travers)在伦敦大学学院发现。在此之前,他们从液态空气中提取了氖,氩和氪,并且疑惑它是否包含其它气体。工业家Ludwig Mond给了他们一台新的液态空气机,他们用它提取了更多的稀有气体氪。经过多次蒸馏,他们终于分离出了一种更重的气体,在真空管中它发出漂亮的蓝色光芒。他们意识到它是气体元素“惰性”组的又一个成员,因为其在化学上是惰性的。他选择“ξένος(xenos)”这个希腊文命名氙,意为“陌生的”[4]。
在“惰性气体”中,氙的化合物(含有化学键的)是最先被发现的。巴特列(Neil Bartlett)于1962年将PtF₆蒸汽与Xe混合,得到了橙黄色的XePtF₆晶体,打破了化学界中持续60年之久的“稀有气体对化学反应完全惰性”的神话。[1][4]21世纪,超过100种氙的化合物已经被制造出来。[1][5]
理化性质
物理性质
![]() 氙的原子光谱氙在常温常压下为无色无臭无毒的惰性气体,在放电管中为蓝色至绿色的气体。[6]
氙的原子光谱氙在常温常压下为无色无臭无毒的惰性气体,在放电管中为蓝色至绿色的气体。[6]
原子半径:4.05Å;[6]
共价半径:209pm[1];1.31Å[7];
沸点:-108.10℃(101.325kpa);[6]
三相点:16.130K;[6]
气体密度:5.89kg·m⁻³(273.15K,101.325kpa)[2];
液体密度:3057kg·m⁻³(-108.10℃,101.325kpa);[6]
气液体积比:518.9;[6]
介电常数:1.001238(298K,101.325kpa);[6]
磁化率:-43×10⁻¹cgs·mol⁻¹(298K,101.325kpa);[6]
折射率:1.000702(g,273K,101.325KPa,5893A);[6]
比容:0.180m³·kg⁻¹(294.3K,101.325kPa);
临界温度:289.74K;[6]
临界压力:5764kPa;[6]
临界密度:1100.0kg·m⁻³;[6]
熔化热:17.49kJ·kg⁻¹(161.4K,81.6kPa);
气化热:96.30KJ·kg⁻¹(165.1K,101.325kpa);
比热容:Cp=160.03J/(kg·K)(g,298K,101.325kpa);Cv=96.41J/(kg·K)(g,298K,101.325kpa);
比热比:Cp/Cv=1.67(g,298K,101.325kpa)[1];
蒸气压:2634kPa(253K);4175kPa(273K);5147kPa(283K);
粘度:0.02110mPa·S(g,273K,101.325kPa);0.528mPa·S(l,289.74k);
表面张力:18.7mN·m⁻¹(163K);
导热系数:0.005192W·m⁻¹·K⁻¹(273K,101.325kPa);165.014kh0.07322W·m⁻¹·K⁻¹(l);
化学性质
数据
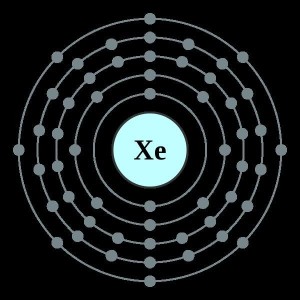 氙的电子排布电子排布:[Kr]5s²5p⁶;
氙的电子排布电子排布:[Kr]5s²5p⁶;
电负性:2.60(泡林标度)[8];
化学键能:Xe-O:84kJ ·mol⁻¹;
氧化态:Xe(0), Xe(II), Xe(IV), Xe(VI), Xe(VIII)[1];
晶体结构:面心立方晶胞;a = 620.23 pm;
电离能(kJ /mol):I₁:1170.4;I₂: 2046;I₃: 3097;I₄: 4300;
I₅: 5500;I₆: 6600;I₇: 9300;I₈: 10600;I₉: 19800;I₁₀: 23000。
氙的电子构型非常稳定,且它的电离能相对较大,因此在化学上显惰性,只与强的氧化剂反应。
氟化反应与氟化氙
氙气与氟气直接混合,可以得到无色的XeF₂,XeF₄与XeF₆晶体[4],氙与氟的比例不同,得到的主产物不同[4]:
Xe:F₂=2:1,1273K,1.03×10⁵Pa[9]或298K,紫外线光照[4]: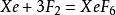 ;
;
Xe:F₂=1:5,873K,6.18×10⁵Pa: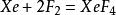 ;
;
Xe:F₂=1:20,573K,6.18×10⁵Pa: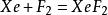 ;
;
若使用镍、钴和钙的氟化物作为催化剂能显著提高上述反应速率,使用Ag₂O或Ni₂O₃则可以在零度时引起氟和氙的爆炸反应。一些氟化物则对反应催化具有选择性,例如在Xe:F₂=1:10,温度为120℃时,使用氟化镁作为催化剂,产物只有XeF₂,若使用二氟化镍作为催化剂,产物则只有XeF₆。[6]
氙的三种氟化物在室温下都能稳定存在。
若将XeF₂溶于水中,则与水缓慢反应,又得到氙气: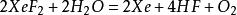
XeF₄与水反应时,一半发生反应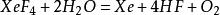 ,另一半则歧化为Xe(0)与Xe(VI):
,另一半则歧化为Xe(0)与Xe(VI):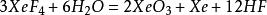 ,反应过程中有疑似XeOF₂的黄色中间产物[4]。
,反应过程中有疑似XeOF₂的黄色中间产物[4]。
XeF₆与水发生的是水解反应: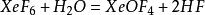 ,生成的XeOF₄则进一步与水反应,直到完全水解:
,生成的XeOF₄则进一步与水反应,直到完全水解: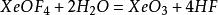 。生成的XeO₃可以溶解于水并稳定存在,不会进一步氧化水。碱性时,XeF₆会歧化为不溶解的高氙酸盐与氙气。[4]
。生成的XeO₃可以溶解于水并稳定存在,不会进一步氧化水。碱性时,XeF₆会歧化为不溶解的高氙酸盐与氙气。[4]
氙的氟化物都是强的氧化剂与氟化剂,在工业生产上有实际用途,例如一些有机物的氟化,使用的就是XeF₂。[4]
含氧化合物
氙的氧化物有XeO₃与XeO₄,对应的酸根为氙酸根(HXeO₄⁻)与高氙酸根(XeO₆⁴⁻)[4]。
XeO₃可用XeF₄或XeF₆与水反应制得[4],XeO₃在酸性与中性溶液中稳定,在碱性溶液中以HXeO₄⁻形式存在,并且不稳定,易分解或歧化[4]。
XeO₄可由高氙酸钡与硫酸复分解制得[4]: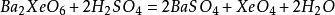 ,XeO₄是一种稳定性差,易爆炸的黄色固体,氧化性极强[4]。
,XeO₄是一种稳定性差,易爆炸的黄色固体,氧化性极强[4]。
除上边所述的XeF₆歧化制法,高氙酸盐亦可通过XeO₃的碱溶液与臭氧反应制得。[1]
复合氟化物
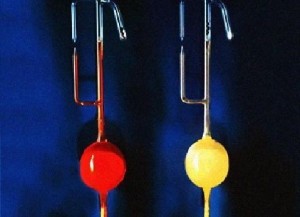 六氟化铂(左)与六氟合铂酸氙(右)在氙的化合物的发现史上,复合氟化物占有重要的地位。氙的第一个真正意义上的化合物正是复合氟化物氟铂酸氙(Xe⁺PtF₆⁻),它是用Xe与强氧化剂PtF₆混合产生的:
六氟化铂(左)与六氟合铂酸氙(右)在氙的化合物的发现史上,复合氟化物占有重要的地位。氙的第一个真正意义上的化合物正是复合氟化物氟铂酸氙(Xe⁺PtF₆⁻),它是用Xe与强氧化剂PtF₆混合产生的: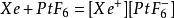 。随着Xe与PtF₆的用量的不同,氟铂酸氙的组成可以在Xe⁺:PtF₆⁻=0.5:1之间变化。氟铂酸氙是一种发粘的橙黄色固体,在室温下稳定,遇水分解出氙,氧气,氟化氢和二氧化铂(IV)。其他一些金属的六氟化物也可以与氙反应生成形如XeMF₆的化合物。[6]
。随着Xe与PtF₆的用量的不同,氟铂酸氙的组成可以在Xe⁺:PtF₆⁻=0.5:1之间变化。氟铂酸氙是一种发粘的橙黄色固体,在室温下稳定,遇水分解出氙,氧气,氟化氢和二氧化铂(IV)。其他一些金属的六氟化物也可以与氙反应生成形如XeMF₆的化合物。[6]
将氙、氟和固态PF₅混合并辉光放电,可以生成不稳定的XePF₆,同时氙、氟和玻璃仪器反应产生Xe₂SiF₆。将二氟化氙和一些金属的五氟化物反应也可以生成XeMF₆型的化合物。[6]
其它化合物
含有Xe-N键与Xe-C的化合物均被发现,典型代表是FXeN(SO₂F)₂与[Xe(C₆F₅)]·[C₆F₅BF₃][1]。
氙还有氢醌包合物形式的化合物,其中氙被捕集至氢醌的晶格之中。[1]
工业制备
氙在空气中的储量达到19.5亿吨,因此通过分馏液态空气是制取氙的良好途径。氙是空分工业的副产物。[6]首先液化空气,分馏出液氧,稀有气体即富集于其中,通过进一步分馏,提纯可分离出稀有气体的混合液。173K时使用活性炭吸附,Ar,Kr与Xe被吸附,通过改变温度及其他条件,可以获得氙。[1]
工业领域
 高压氙气灯的白色氙广泛用于电子、光电源工业,还用于气体激光器和等离子流中。用氙气充的灯泡与相同功率的充氩灯泡相比具有发光率高、体积小、寿命长、省电等优点。氙气灯有极高的发光强度,一盏六万瓦的氙灯的亮度,相当于九百只一百瓦的普通灯泡。由于氙具有几乎连续的光谱,因此可以在高压电弧放电作用下产生类似日光的明亮白光[4],这种长弧氙灯俗称“人造小太阳”[1],由于透雾能力特别强,可用作有雾导航灯。氙闪光灯的色彩好,用于拍摄彩色电影。
高压氙气灯的白色氙广泛用于电子、光电源工业,还用于气体激光器和等离子流中。用氙气充的灯泡与相同功率的充氩灯泡相比具有发光率高、体积小、寿命长、省电等优点。氙气灯有极高的发光强度,一盏六万瓦的氙灯的亮度,相当于九百只一百瓦的普通灯泡。由于氙具有几乎连续的光谱,因此可以在高压电弧放电作用下产生类似日光的明亮白光[4],这种长弧氙灯俗称“人造小太阳”[1],由于透雾能力特别强,可用作有雾导航灯。氙闪光灯的色彩好,用于拍摄彩色电影。
氙灯可以放出紫外线,医疗上对此有所应用[9]。氙的同位素被用于测量脑血流量与研究肺功能、计算胰岛素分泌量等[4][9]。
氙灯凹面聚光后可生成2500℃高温,可用于焊接或切割难熔金属,如钛、钼等。
氙还是一种没有副作用的深度麻醉剂[2][4],它能溶于细胞质的油脂中,引起细胞的膨胀和麻醉,从而使神经末梢的作用暂时停止。人们曾试用4/5的氙气和1/5的氧气组成混合气体,作为麻醉剂,效果很好。只是由于氙气很少,所以这种方法不能广泛应用。
由于可以吸收X射线,氙也被用作X射线的屏蔽。[2]
此外,氙在原子核反应堆和高能物理方面也有很多用途。
健康危害
氙为非腐蚀性气体,且本身无毒,人吸入后以原形排出,但在高浓度时有窒息作用。氙有麻醉性,它和氧的混合物是对人体的一种麻醉剂[4]。
同位素
氙的同位素中,¹¹⁰Xe至¹⁴⁷Xe均被实验室制得,其中能稳定存在的是¹²⁴Xe,¹²⁶Xe,¹²⁸Xe~¹³²Xe,¹³⁴Xe与¹³⁶Xe,自然界中丰度最大的是¹³²Xe。[2][10]
元素分布
空气中含量:约90ppm;
地壳中含量:2×10⁻⁶ppm[7];
元素在海水中的含量:1×10⁻⁴ppm[7];
大气中的Xe主要来自原始生成,岩石圈、小行星、陨石通过风化作用释放出其中的稀有气体。宇宙射线和其他高能粒子的核反应也能产生少量Xe。[6]



 求购
求购





